微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室中,通常以草酸钠(Na2C2O4)为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化程程为:C2O42—+MnO4—+H+—Mn2++CO2↑+H2O(未配平)下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是
A.配制草酸钠标准液时,直接将Na2C2O4固体溶于容量瓶的水中即可
B.滴定过程中,高锰酸钾被氧化,草酸钠被还原
C.该反应中,消耗的草酸钠与高锰酸钾物质的量之比为5:2
D.为便于滴定终点的判断,滴定时必须往体系中加入指示剂
参考答案:C
本题解析:
分析:A、高锰酸钾具有强氧化性,能将草酸钠氧化;
B、草酸钠滴定高锰酸钾常温下就可以反应,实验必须在室温下进行;
C、化学反应中的是电子的数目必须相等;
D、进行滴定实验时,指示剂的加入必须是根据反应物的特点来选择的.
解:A、高锰酸钾具有强氧化性,草酸具有还原性,高锰酸钾能将草酸钠氧化,高锰酸钾被还原,草酸钠被氧化,故A错误;
B、滴定实验必须在常温条件下发生,草酸钠与高锰酸钾的反应常温下即可发生,故B错误;
C、高锰酸钾中的锰离子由+7价降为+2价,共得到5mol电子,草酸钠中碳元素的化合价由+3价升为+4价,共失去2mol电子,要使得失电子守恒,消耗的草酸钠与高锰酸钾的物质的量之比应为5:2,故C正确;
D、高锰酸钾本身为紫红色,以草酸钠(Na2C2O4)为标准液进行滴定时,滴定终点的判断依据是紫红色消失,不需要加指示剂,故D错误.
故选C.
本题难度:简单
2、选择题 高铁酸钾是一种理想的绿色水处理剂,工业上可通过如下反应制得:
Fe(OH)3+ClO-+OH- 一FeO42-+Cl- +H2O(未配平),在上述反应中(? )
A.FeO42-是还原产物
B.ClO-是还原剂
C.1molFe(OH)3得到3mol电子
D.配平后OH- 的化学计量数为4
参考答案:D
本题解析:略
本题难度:一般
3、选择题 三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
①?C3N3(OH)3 3HNCO
3HNCO
②?8HNCO+6NO2 7N2+8CO2+4H2O
7N2+8CO2+4H2O
(两个方程式中所有碳元素的化合价均为+4)
下列说法正确的是
A.反应①、②均是氧化还原反应
B.反应②中N2既是氧化产物、又是还原产物
C.反应②中,每转移1mol电子,NO2被氧化0.25 mol
D.反应②中氧化剂、还原剂的物质的量之比为4∶3
参考答案:B
本题解析:
正确答案:B
A.不正确,反应②是氧化还原反应,①是非氧化还原反应;
B.正确,反应②中N 从-3价和+4价均变成0价, N2既是氧化产物、又是还原产物
C.不正确,反应②中,每转移1mol电子,NO2中氮降4价,NO2被还原0.25 mol
D.不正确,反应②中氧化剂、还原剂的物质的量之比为6:8=3∶4
本题难度:简单
4、选择题 下列反应中,氧化剂与还原剂物质的量关系为1∶2的是
A.O3+2KI+H2O===2KOH+I2+O2
B.2CH3COOH+Ca(ClO)2===2HClO+Ca(CH3COO)2
C.I2+2NaClO3===2NaIO3+Cl2
D.4HCl(浓)+MnO2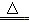 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
参考答案:AD
本题解析:A中臭氧是氧化剂,碘化钾是还原剂,二者的物质的量之比是1︰2,A正确;选项B不是氧化还原反应,不正确;C中氧化剂是NaClO3,还原剂是I2,二者的物质的量之比是2︰1,不正确;D中MnO2是氧化剂,HCl是还原剂,但只有一半的HCl被氧化,所以氧化剂和还原剂的物质的量之比是1︰2,D正确,答案选AD。
本题难度:一般
5、选择题 下列判断正确的是.
[? ]
A.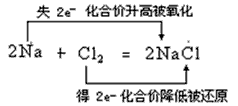
B.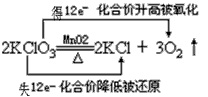
C.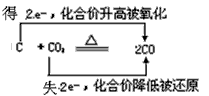
D.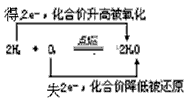
参考答案:A
本题解析:
本题难度:一般