微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对0.1 mol·L-1的醋酸溶液进行以下操作,下列分析判断正确的是()
A.加入少量0.1 mol·L-1的硫酸,水电离产生的c(H+)减小
B.升高温度,溶液的pH会增大
C.加入少量固体NaOH,溶液中c(CH3COO-)+c(OH-)>c(Na+)+c(H+)
D.与0.1 mol·L-1的NaOH溶液等体积混合后,溶液中c(CH3COO-)=c(Na+)
参考答案:A
本题解析:硫酸是强酸,增大溶液中氢离子的浓度,所以由水电离出的氢离子浓度减小,A正确;升高温度,促进醋酸的电离,溶液的酸性增强,pH降低,B不正确;C不正确,不符合电荷守恒,应该是c(CH3COO-)+c(OH-)=c(Na+)+c(H+);D中酸碱恰好反应,生成的醋酸钠水解溶液显碱性,则根据电荷守恒可知,c(CH3COO-)<c(Na+),D不正确,答案选A。
点评:该题是基础性试题的考查,也是高考中的常见常见考点和题型。试题难易适中,基础性强,侧重对学生基础知识的巩固和训练,主要是考查学生灵活运用基础知识解决实际问题的能力。该题的关键是利用好几种守恒关系即电荷守恒定律,物料守恒电律,质子守恒定律。
本题难度:简单
2、选择题 下列说法正确的是
A.常温下,某溶液中由水电离的C(OH-)=10-3 mol/L,则该溶液可能为NH4Cl或NaOH溶液
B.常温时浓度均为1 mol/L的KHCO3和K2CO3溶液中,由水电离的C(OH-)前者大于后者
C.1 mL PH=1的H2SO4与100 mLNaOH溶液混合后PH=7,则原NaOH溶液PH=11
D.25℃时PH=5的CH3COOH溶液和100℃时PH=5的AlCl3溶液C(H+)相等
参考答案:D
本题解析:A 错误,由水电离的C(OH-)=10-3 mol/L大于10-7 mol/L,所以,是促进水的电离,有弱离子的盐能促进水的电离,碱会抑制水的电离。不会是NaOH溶液
B 错误,KHCO3水解程度小于K2CO3,溶液中水的电离程度KHCO3溶液小于K2CO3,由水电离的C(OH-)前者小于后者
C 错误,题中没有表明温度
D 正确,PH相同,溶液中H+浓度相同。
本题难度:简单
3、填空题 (7分)已知:A酸的溶液pH=a,B碱的溶液pH="b?"
(1)若A为盐酸,B为氢氧化钡,且a+b=14,两者等体积混合,溶液的pH=?。酸碱按体积比为1:10混合后溶液显中性,则a+b=?。
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为?mo1·L–l,B溶液中水电离出的氢离子浓度为?mol·L–1。
(3)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA ??VB,混合后溶液中的离子浓度关系为c(Na+)??c(CH3COO—)。?
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为??。
参考答案:(7分)(1)pH="?7?" ?。a+b="?13?" 。
(2)为?10—10? mo1·L–l,为?10—12?mol·L–1。(3)VA <? VB, c(Na+)=?c(CH3COO—)。
(4)离子方程式为?M++H2O MOH+H+
MOH+H+
本题解析:略
本题难度:一般
4、实验题 (12分)某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
指示剂
| 石蕊
| 甲基橙
| 甲基红
| 酚酞
|
变色范围(PH)
| 5.0-8.0
| 3.1-4.4
| 4.4-6.2
| 8.2-10.0
|
(1)该实验应选用?作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是?。
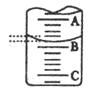
(2)下图表示50ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为25,滴定管中液面读数为?ml。此时滴定管中液体的体积?。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为Vml,NaOH标准液浓度为C mol/L,三次实验结果记录如下:
实验次数
| 第一次
| 第二次
| 第三次
|
消耗NaOH溶液体积/ml
| 26.02
| 25.32
| 25.28
|
从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,其原因可能
是?
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(可以不必化简):?
(酸度:每100ml溶液中含有溶质酸的质量,单位:g/100ml)
参考答案:(1)酚酞,酸式滴定管(或移液管)(2)25.40;大于24.60mL(3)BCD
(4)
本题解析:醋酸钠显碱性用酚酞,第一次实验中记录消耗NaOH溶液体积明显多于后两次,其原因可能滴定前滴定管尖嘴有气泡,滴定结束无气泡V1偏小,盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗,标液浓度偏低,要的体积多些。.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,锥形瓶不需要润洗,洗了酸液多了要的碱液多了。
本题难度:一般
5、选择题 在101kPa 25℃时,1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则乙烷燃烧的热化学方程式为
A.C2H6(g) + 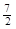 O2(g)=2CO2(g) +3H2O(l)△H =-1560kJ·mol-1
O2(g)=2CO2(g) +3H2O(l)△H =-1560kJ·mol-1
B.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(g)△H =-1560kJ·mol-1
C.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(l)△H =+3120 kJ·mol-1
D.C2H6(g) +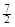 O2(g)=2CO2(g) +3H2O(l)△H =-52.0kJ·mol-1
O2(g)=2CO2(g) +3H2O(l)△H =-52.0kJ·mol-1
参考答案:A
本题解析:乙烷燃烧属于放热反应,△H<0,则C项错误;根据“1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ”得“1.0mol乙烷气体完全燃烧生成液态水时放出热量52×30=1560kJ”,则A项正确,B、D项错误。
本题难度:一般