微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氧化还原反应的实质是______;元素的化合价降低,发生的是______反应;氧化还原反应中,还原剂______电子(填“得”或“失”);试写出Na2O2与H2O反应的化学方程式,并用双线桥标出电子转移的方向和数目:______.
参考答案:氧化还原反应的实质是电子转移或电子对偏移,元素的化合价降低,发生的是还原反应,氧化还原反应中,元素失去电子化合价升高,化合价升高元素所在的反应物是还原剂,在Na2O2与H2O的反应中,化合价升高数=化合价降低数=转移电子数=2,电子转移情况为:
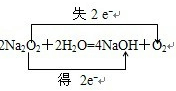
,故答案为:电子的得失或电子对偏移;还原;失;

.
本题解析:
本题难度:简单
2、选择题 有关氧化还原反应实质的说法中正确的是
[? ]
A.是否有元素的电子转移
B.是否有元素的化合价的变化
C.是否有氧元素的参加
D.是否有原子的重新组合
参考答案:A
本题解析:A答案氧化还原反应实质就是是否有电子转移。
本题难度:简单
3、选择题 下列既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸反应
B.Ba(OH)2?8H2O与NH4Cl的反应
C.灼热的炭与水蒸气的反应
D.甲烷(CH4)在O2中的燃烧反应
参考答案:A.铝片与稀盐酸的反应为放热反应,故A错误;
B.Ba(OH)2?8H2O与NH4Cl的反应为吸热反应,但不是氧化还原反应,故B错误;
C.灼热的炭与水蒸气的反应为氧化还原反应,同时也是吸热反应,故C正确;
D.甲烷(CH4)在O2中的燃烧为放热反应,故D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 人体正常血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化为Fe3+而中毒,服用维生素C可以解毒.对上述事实分析正确的是( )
A.亚硝酸盐是还原剂
B.维生素C是氧化剂
C.亚硝酸盐将Fe3+还原成Fe2+
D.维生素C被Fe3+氧化
参考答案:服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+,Fe元素化合价降低,被氧化,则维生素具有还原性,而亚硝酸盐,会导致Fe2+转化为Fe3+,说明亚硝酸盐具有氧化性,在反应中为氧化剂,
故选D.
本题解析:
本题难度:简单
5、简答题 利用化合价和物质类别推测物质的性质是化学研究的重要手段.
(1)从化合价的角度可以预测物质的性质.
①SO2的性质______(填序号,下同).
A.只有氧化性B.只有还原性C.既有氧化性又有还原性
②将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色.反应结束后,硫元素存在形式合理的是______
A.S2- B.S C.SO32- D.SO42-
(2)从物质分类的角度可以推测物质的性质.
①已知蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成.其中SiO2属于______氧化物,MgO和Fe2O3属于______氧化物(填“酸性”、“碱性”或“两性”).
②现取一份蛇纹石试样进行实验:
Ⅰ.先将其溶于过量的盐酸中、过滤,滤渣的主要成分是______.
Ⅱ.再向滤液中加入NaOH溶液至过量、过滤,滤渣中的主要成分是______.
③若将少量的蛇纹石试样直接溶于过量的NaOH溶液中,所发生的两个反应的化学方程式是______.
参考答案:(1)①最高价元素只有氧化性,最低价元素只有还原性,中间价态的元素既有氧化性又有还原性,二氧化硫中硫元素是中间价态,所以既有氧化性又有还原性,故选C;
②在该反应中二氧化硫失电子作还原剂,硫元素化合价升高,故选D;
(2)①二氧化硅和氢氧化钠溶液反应生成盐和水,所以属于酸性氧化物,氧化镁和氧化铁与盐酸反应生成盐和水,所以属于碱性氧化物,故答案为:酸性;碱性;
②氧化镁、氧化铝、氧化铁都和盐酸反应生成盐和水,二氧化硅和盐酸不反应,所以滤渣的主要成分是SiO2,故答案为:SiO2;
II镁离子、铁离子和铝离子都能与氢氧根离子反应生成沉淀,但氢氧化铝能和过量的氢氧化钠反应生成可溶性的偏铝酸盐,氢氧化镁和氢氧化铁不与氢氧化钠反应,所以滤渣中的主要成分是Fe(OH)3、Mg(OH)2,
故答案为:Fe(OH)3、Mg(OH)2;
③二氧化硅和氧化铝与氢氧化钠溶液反应生成盐和水,氧化镁和氧化铁与氢氧化钠溶液不反应,所以涉及的反应方程式为:SiO2+2NaOH=Na2SiO3+H2O,Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:SiO2+2NaOH=Na2SiO3+H2O,Al2O3+2NaOH=2NaAlO2+H2O.
本题解析:
本题难度:一般