微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A.该硫酸的物质的量浓度为9.2 mol/L
B.若该硫酸与等体积的水混合,所得溶液的质量分数小于49%
C.若实验室需要4.6 mol/L的稀硫酸480 mL,则应用量筒量取该硫酸125.0mL
D.等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2 mol/L
参考答案:C
本题解析:根据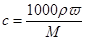 可知,硫酸的浓度是
可知,硫酸的浓度是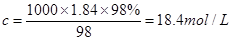 ,A不正确;由于硫酸的密度随浓度的增大而增大,所以若该硫酸与等体积的水混合,所得溶液的质量分数大于49%,B不正确;由于容量瓶的规格没有480ml的,因此应该选择500ml容量瓶,则需要浓硫酸的体积是
,A不正确;由于硫酸的密度随浓度的增大而增大,所以若该硫酸与等体积的水混合,所得溶液的质量分数大于49%,B不正确;由于容量瓶的规格没有480ml的,因此应该选择500ml容量瓶,则需要浓硫酸的体积是 ,选项C正确;等质量的水与该硫酸混合所得溶液的质量分数是49%,由于硫酸的密度随浓度的增大而增大,所以根据
,选项C正确;等质量的水与该硫酸混合所得溶液的质量分数是49%,由于硫酸的密度随浓度的增大而增大,所以根据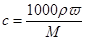 可知,所得溶液的物质的量浓度小于9.2 mol/L,答案选C。
可知,所得溶液的物质的量浓度小于9.2 mol/L,答案选C。
本题难度:一般
2、选择题 取100mL?0.3mol/L和300mL?0.25mol/L的硫酸混合后加水配制成500mL溶液,该混合溶液中H+的物质的量浓度是
A.0.21mol/L
B.0.42mol/L
C.0.56mol/L
D.0.24mol/L
参考答案:B
本题解析:分析:先利用n=cV来计算每份硫酸溶液中硫酸的物质的量,从而计算出H+的物质的量,再利用混合后溶液的体积及c= 来计算H+的物质的量浓度.
来计算H+的物质的量浓度.
解答:100mL0.3mol/L硫酸溶液中硫酸的物质的量为0.1L×0.3mol/L=0.03mol,
300mL0.25mol/L的硫酸溶液中硫酸的物质的量为0.3L×0.25mol/L=0.075mol,
则混合后硫酸的物质的量为0.03mol+0.075mol=0.105mol,
H+的物质的量为0.105mol×2=0.21mol,
则该混合溶液中H+的物质的量浓度为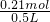 =0.42mol/L,
=0.42mol/L,
故选B.
点评:本题考查物质的量浓度的计算,明确物质的量、溶液的体积、浓度之间的关系及硫酸与氢离子的关系即可解答,难度不大.
本题难度:简单
3、选择题 在无土栽培中,需配制一定量含50mol NH4Cl、16mol KCl和24mol K2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)(?)
A.64、2、24
B.30、50、12
C.16、50、24
D.2、64、24
参考答案:A
本题解析:略
本题难度:一般
4、选择题 下列选项中,符合图所示关系的是( )
A.一定状况下,气体摩尔体积(Y)与该气体的物质的量(X)的关系
B.Fe在Cl2中燃烧,生成FeCl3的物质的量(Y)与消耗Cl2的物质的量(X)的关系
C.向AlCl3溶液中滴加NaOH溶液至过量,生成Al(OH)3的物质的量(Y)与消耗NaOH的物质的量(X)的关系
D.H2SO4溶液的物质的量浓度(Y)与溶液体积(X)的关系