微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 下面是几种实验中常用的仪器:
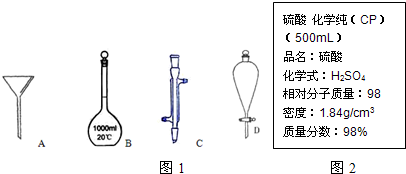
(1)写出图1序号所代表的仪器的名称:B______;C______;D______.
(2)图2是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
现用该浓硫酸配制100mL 1mol/L的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.
请回答下列问题:
Ⅰ配制稀硫酸时,上述仪器中不需要使用的有______(选填序号),还缺少的仪器有______(写仪器名称);
Ⅱ经计算,该浓硫酸的物质的量浓度为______mol/L.配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为______mL(保留一位小数),量取浓硫酸时应选用______(选填①10mL、②50mL、③100mL)规格的量筒;
Ⅲ用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是______(填序号);
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓盐酸
D.重新配制
Ⅳ用该浓硫酸配制100mL1mol/L稀硫酸的正确顺序是______;
A.冷却?B.量取?C.洗涤?D.定容?E.溶解?F.摇匀?G.移液
Ⅴ将所配制的稀硫酸进行测定,发现浓度大于1mol/L.请你分析配制过程中可能引起该误差的原因是(填序号)______;
①容量瓶不干燥,含有少量蒸馏水?②定容时俯视刻度线?③定容时仰视刻度线
④未冷却至室温就转移到容量瓶中?⑤没有洗涤烧杯和玻璃棒
Ⅵ请写出“定容”的具体操作:______.
参考答案:(1)图中各仪器的名称是:B为1000ml容量瓶,C为冷凝管,D为分液漏斗,故答案为:1000ml容量瓶;冷凝管;分液漏斗;
(2)Ⅰ配制稀硫酸时,上述仪器中不需要使用的有②④⑥,还需要的仪器有:配制溶液的仪器100mL容量瓶、起引流和搅拌作用的玻璃棒,故答案为:②④⑥,100mL容量瓶、玻璃棒;
ⅡC=103ρwM=103×1.84×98%98mol/L=18.4mol/L,稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以
18.4 mol/L×V=1mol/L×0.1L,V=0.0054L=5.4mL,所以应该选取10mL量筒,
故答案为:18.4;5.4;①;
Ⅲ用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,应该重新配制,故选D;
Ⅳ配制时,一般可分为以下几个步骤:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀,所以其排列顺序为:BEAGCGDF,故答案为:BEAGCGDF;
Ⅴ①容量瓶不干燥,含有少量蒸馏水,溶质的物质的量和溶液的体积都不变,所以无影响;
?②定容时俯视刻度线,溶液的体积偏小,配制溶液的浓度偏大;?
③定容时仰视刻度线,溶液的体积偏大,配制溶液的浓度偏小;
④未冷却至室温就转移到容量瓶中,溶液的体积偏小,配制溶液的浓度偏大;?
⑤没有洗涤烧杯和玻璃棒,溶质的物质的量偏小,配制溶液的浓度偏低;
故选②④;
Ⅵ定容时的操作是:加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切,
故答案为:加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切.
本题解析:
本题难度:一般
2、填空题 实验室用Na2CO3?10H2O配制500ml0.10mol?L-1的Na2CO3溶液,填空并请回答下列问题:
(1)根据实验要求填表:
| 应量取Na2CO3?10H2O的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器
______
______
______
|
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)______;
A.用适量水洗涤烧杯2-3次,洗涤液均注入容量瓶中,振荡.
B.用电子天平准确称量所需Na2CO3?10H2O的质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(需要时可加热).
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作______;若加蒸馏水时不慎超过了刻度______;若定容时俯视刻度线______.
参考答案:(1)需十水合碳酸钠的质量为m=0.5L×0.1mol?L-1×286g/mol=14.3g;
配制500ml0.10mol?L-1的Na2CO3溶液,需要500mL容量瓶;
操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,故需要的仪器有:托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管、药匙,故还需玻璃仪器有:烧杯、玻璃棒、胶头滴管,
故答案为:14.3;500mL;烧杯、玻璃棒、胶头滴管;
(2)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,故正确的操作顺序为:BCAFED,
故答案为:BCAFED;
(3)未洗涤烧杯、玻璃棒,少量碳酸钠沾在烧杯壁与玻璃棒上,碳酸钠的实际质量减小,溶液浓度偏低;
若加蒸馏水时不慎超过了刻度,所配溶液的体积偏大,溶液的浓度偏低;
定容时,俯视刻度线,导致溶液体积偏小,所配溶液浓度偏高,
故答案为:偏低;偏低;偏高.
本题解析:
本题难度:一般
3、选择题 配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是( )
A.容量瓶事先没有烘干
B.定容时观察液面俯视
C.定容时观察液面仰视
D.定容后,摇匀时有少量液体流出
参考答案:C
本题解析:
本题难度:一般
4、实验题 某学生进行实验需要90mL 2.00mol/L-1的NaOH溶液,该生利用中学实验室条件进行溶液配制,试回答下列各题:
(1)下列仪器中,必须用到的是_____________
A.锥形瓶? B.200mL容量瓶?C.量筒? D.胶头滴管 E.100mL容量瓶? F.天平
(2)该生需要称量的NaOH固体质量为____________;若要实施配制,除上述仪器外,还缺少的仪器是_____________________。
(3)容量瓶上除有刻度线和规格(或容积)外还应标有________,在使用前必须的操作是_______________。
(4) 如图所示,下列实验操作与方法正确的是:(?)

(5)配制完毕后,教师指出有部分同学进行了下列某一项错误操作,你认为这些操作会导致所得溶液浓度偏高的是_______________
A.容量瓶使用前经蒸馏水清洗后没有干燥
B.将溶解后的溶液立即转入容量瓶
C.洗涤烧杯和玻璃棒的溶液倒入水槽中
D.反复倒转摇匀后,液面低于刻度线,再加蒸馏水至刻度线
E.定容时俯视容量瓶刻度线
F.定容时仰视容量瓶刻度线
参考答案:(1)DEF
(2) 4.0g;玻璃棒、烧杯
(3)温度;检漏
(4)A?
(5)BE
本题解析:
本题难度:一般
5、选择题 配制一定物质的量浓度的NaCl溶液,下列操作正确的是( )
A.称量时,将NaCl固体直接放在托盘天平的右盘上
B.将NaCl固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中
C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
参考答案:A、称量时,将NaCl固体放在垫有白纸的托盘天平的左盘上,故A错误;
B、配制氯化钠溶液时,将NaCl固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中,故B正确;
C、定容时如果加水超过了刻度线,导致配制的溶液体积偏大,溶液浓度偏低,正确方法是重新配制,不能用胶头滴管直接吸出多余部分,故C错误;
D、由于容量瓶的刻度线上方存有部分溶液,定容摇匀后发现溶液体积低于刻度线,属于正常现象,不能补加少量蒸馏水至刻度线,否则导致溶液体积偏大,浓度偏低,故D错误;
故选B.
本题解析:
本题难度:简单