微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电离方程式书写正确的是?(?)
A.HClO  H+ + ClO
H+ + ClO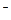

B.H2SO
 2H+ + SO
2H+ + SO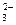
C.Ba(OH)2 ="===" Ba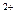 +2O
+2O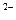 +2H
+2H
D.NaHCO ====Na
====Na +H
+H +CO
+CO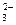
参考答案:A
本题解析:略
本题难度:一般
2、填空题 现有四种可溶性物质A、B、C、D,它们所含的阴、阳离子互不相同,分别为四种阳离子Na+、Al3+、Ba2+、Fe3+和四种阴离子Cl-、OH-、CO32-、SO42-中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是_____和______(填化学式)。
(2)现将(1)中的两种物质记为A和B。剩余两种物质编号为C、D,然后两两混合,其中当A与C的溶液混合时,只产生红褐色沉淀,则:
①A中的化学键类型为__________。
②B的水溶液中所有离子的浓度由大到小的顺序为______________。(用离子符号表示)
③请描述将D和B混合的实验现象并写出对应的离子方程式_____________________;?_________________________。
参考答案:(1)Ba(OH)2、Na2CO3(或Na2CO3、Ba(OH)2)
(2)①离子键、(极性)共价键;②c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);③产生了白色沉淀和无色无味的气体;2Al3++3CO32-+3H2O?=2Al(OH)3↓+3CO2↑
本题解析:
本题难度:一般
3、选择题 草酸是二元中弱酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol·L-1 NaHC2O4溶液中滴加0.01
mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
[? ]
A.V(NaOH) = 0时,c(H+) = 1×10-2 mol·L-1
B.V(NaOH)<10 mL时,不可能存在c(Na+) = 2c(C2O42-)+c(HC2O4-)
C.V(NaOH) = 10 mL时,c(H+) = 1×10-7 mol·L-1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列各组离子在指定的环境中能大量存在的是
A.pH=1的无色溶液中:SO42-、Cu2+、Na+、Cl-
B.能使石蕊试纸变蓝色的溶液中:Na+、K+、S2-、CO32-
C.加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、NO3-
D.水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO3-
参考答案:B
本题解析:分析:A、Cu2+在水溶液中为蓝色;
B、使石蕊试纸变蓝色的溶液显碱性;
C、加入铝粉能产生H2的溶液,可能为酸或碱的溶液;
D、水电离出的c(H+)=1×10-12mol/L的溶液,水的电离受到抑制,可能为酸或碱的溶液.
解答:A、pH=1的溶液中存在大量的H+,该组离子之间不反应,能共存,但Cu2+在水溶液中为蓝色,与无色溶液不符,故A错误;
B、石蕊试纸变蓝色的溶液显碱性,碱性条件下该组离子之间不反应,能够大量共存,故B正确;
C、加入铝粉能产生H2的溶液,可能为酸或碱的溶液,酸溶液时,Fe2+、NO3-发生氧化还原反应,则不能大量共存,若为碱溶液时,NH4+、OH-结合,Fe2+、OH-结合,则也不能大量共存,故C错误;
D、水电离出的c(H+)=1×10-12mol/L的溶液,水的电离受到抑制,可能为酸或碱的溶液,HCO3-既能与H+反应,又能与OH-反应,则一定不能大量共存,故D错误;
故选B.
点评:本题考查离子的共存问题,明确信息中隐含条件的挖掘和应用是解答本题的关键,并熟悉离子之间的反应来解答即可.
本题难度:一般
5、选择题 下列物质中,属于电解质的是( )
A.饱和食盐水
B.酒精
C.铜
D.氯化氢
参考答案:D
本题解析:
本题难度:一般