微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (5分)含有相同原子个数的SO2和SO3,其质量比为 ,摩尔质量比为 ,物质的量比为 ,其中所含氧原子个数比为 ,硫原子个数比为 .
参考答案: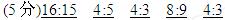
本题解析:略
本题难度:一般
2、选择题 下列说法正确的是( )
A.1 mol任何物质都含有6.02×1023个原子
B.0.012 kg12C约含有6.02×1023个碳原子
C.硫酸的摩尔质量是98 g
D.常温常压下,1 mol氧气的体积为22.4 L
参考答案:B
本题解析:物质不一定都是由1个原子组成的,选项A不正确;0.012 kg12C的物质的量是12g÷12g/mol=1ml,约含有6.02×1023个碳原子,选项B正确;摩尔质量的单位是g/mol,选项C不正确;常温常压下,气体的摩尔体积不是22.4L/mol,选项D不正确,答案选B。
点评:阿伏加德罗常数是历年高考的“热点”问题。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。其解题的方法思路是,在正确理解有关概念的基础上,将各物质的质量、气体的体积、溶液的浓度等转化为指定粒子的物质的量(mol)进行判断。
本题难度:一般
3、填空题 12.4g?Na2R含Na+0.4mol,则Na2R的摩尔质量为______,R的相对原子质量为______.含R的质量为1.6g的Na2R,其物质的量为______.
参考答案:根据化学式可知Na2R中n(Na+)=2n(Na2R),所以含有0.4molNa+的Na2R的物质的量为0.4mol2=0.2mol,所以Na2R的摩尔质量为12.4g0.2mol=62g/mol;
当摩尔质量以g/mol作单位,数值上等于其相对分子质量,即Na2R的相对分子质量为62,所以R的相对原子质量为62-23×2=16;
1.6gR的物质的量为1.6g16g/mol=0.1mol,根据化学式可知Na2R中n(Na2R)=n(R)=0.1mol.
故答案为:62g/mol;16;0.1mol.
本题解析:
本题难度:一般
4、选择题 已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的
倍,下列叙述中正确的是( )
A.溶液中一定有1molNa2SO4和3molNaCl
B.所带电荷数SO42-是Na+的倍
C.SO42-与Cl-的物质的量之和等于Na+的物质的量
D.Na2SO4和NaCl的物质的量之比为1:3
参考答案:A、未给出溶液体积,无法得到具体的物质的量,故A错误;
B、溶液呈电中性,由电荷守恒,所以2Q(SO42-)+Q(Cl-)=Q(Na+),由于Cl-的物质的量浓度是Na+的物质的量浓度的35倍,所以Q(Cl-)=35Q(Na+),使用Q(SO42-)=15Q(Na+),故B错误;
C、溶液呈电中性,阴阳离子所带电荷总数相等,所以2n(SO42-)+n(Cl-)=n(Na+),故C错误;
D、溶液呈电中性,阴阳离子所带电荷总数相等,所以2n(SO42-)+n(Cl-)=n(Na+),由于Cl-的物质的量浓度是Na+的物质的量浓度的35倍,所以n(Cl-)=35n(Na+),则n(SO42-)=15n(Na+),所以Na2SO4和NaCl的物质的量之比为1:3,故D正确.
故选D.
本题解析:
本题难度:一般
5、计算题 (6分) 5.3g Na2CO3正好与20mL盐酸完全反应(Na2CO3+2HCl=2NaCl+CO2↑+H2O)。问这种盐酸的物质的量浓度c(HCl)=________________________产生的CO2在标准状况下的体积V(CO2)="_____________________"
参考答案:5 mol/L? 1.12 L?(每空3分,单位不对,扣1分)
本题解析:5.3g碳酸钠的物质的量是5.3g÷106g/mol=0.05mol。根据方程式可知,消耗1mol碳酸钠的同时必然消耗2mol氯化氢,所以参加反应的氯化氢的物质的量是0.05mol×2=0.1mol,因此元素的浓度是0.1mol÷0.02L=5mol/L。生成CO2的物质的量是0.05mol,标准状况下的体积是0.05mol×22.4L/mol=1.12L。
本题难度:一般