微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温时,下列叙述正确的是
A.pH=9的NH4Cl与NH3·H2O混合溶液中c(Cl-)>c(NH4+)
B.pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的1 0倍
C.AgCl在0.1 mol/L CaCl2溶液和0.l mol/L NaCl溶液中的溶解度相同
D.1 mL l mol l L Na2CO3溶液加水稀释至100 mL,pH和Kw均减小
参考答案:B
本题解析:A、pH=9的NH4Cl与NH3·H2O混合溶液中NH3·H2O的电离程度大于NH4Cl的水解程度,所以c(Cl-)<c(NH4+),错误;B、pH=2.5的可乐中c(H+)=1×10-2.5mol/L,pH=3.5的柠檬水中c(H+)=1×10-3.5mol/L,前者是后者的10倍,正确;C、0.1 mol/L CaCl2溶液和0.l mol/L NaCl溶液中的氯离子的浓度不同,导致AgCl的溶解度不同,错误;D、Kw是温度常数,温度不变,Kw不变,错误,答案选B。w的判断,同一物质在不同溶剂中的溶解度的判断
本题难度:一般
2、填空题 (6分)下列物质:①水②醋酸③盐酸④烧碱⑤硝酸钾⑥酒精⑦汽油⑧蔗糖
(用编号回答)其中属于弱电解质的有 ;属于强电解质的有 ;强电解质在水中 电离。
参考答案:①②;④⑤;完全(几乎完全;全部)
本题解析:略
本题难度:简单
3、选择题 部分弱酸的电离平衡常数如下表:
弱酸
| HCOOH
| HCN
| H2CO3
|
电离平衡常数
(25℃)
| Ki=1.77×10-4
| Ki=4.9×10-10
| Ki1=4.3×10-7
Ki2=5.6×10-11
|
下列选项错误的是
A.HCN+CO32- =CN-+ HCO3-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
参考答案:D
本题解析:A.由于HCN的电离平衡常数K=4.9×10-10大于H2CO3的二级电离平衡常数Ki2=5.6×10-11而小于一级电离平衡常数Ki1=4.3×10-7,所以酸性:H2CO3> HCN > HCO3-;因此向Na2CO3的溶液中加入HCN,会发生反应:HCN+CO32- =CN-+ HCO3-,正确;B.由于HCOOH的电离平衡常数Ki=1.77×10-4>H2CO3的一级电离平衡常数Ki1=4.3×10-7;所以会发生反应:2HCOOH+CO32- = 2HCOO-+H2O+CO2↑;正确;C.由于甲酸、HCN都是弱酸,因为电离平衡常数HCOOH>HCN,所以当二者的体积相等、pH相等时,物质的量n(HCN)>n(HCOOH),中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,正确;D.在等体积、等浓度的HCOONa和NaCN溶液中,阴离子都发生水解反应而消耗,由于酸性HCOOH>HCN,所以溶液中c(HCOO-)>c(CN-);水解使溶液显碱性,水解程度越大,溶液的碱性就越强,因此溶液中的c(H+)前者大于后者,所含离子总数前者大于后者,错误。
考点:考查弱酸的电离平衡常数的应用及溶液中离子浓度的大小比较的知识。
本题难度:一般
4、填空题 (16分)
(1)已知298K时,Fe(OH)3的溶度积常数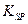 =2.6×10-39,Mg(OH)2的溶度积常数
=2.6×10-39,Mg(OH)2的溶度积常数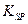 =5.6×
=5.6× ,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
有没有Mg(OH)2沉淀生成______________填“有”或“无”),理由是________________________________。
(2)酸HnA与碱B(OH)m完全反应生成正盐.
①若HnA为HCl,且该盐溶液的pH<7,用离子方程式说明原因:?
②若将0.4mol·L-1的NaOH溶液与0.2mol·L-1的HnA溶液等体积混合后pH=10,
则HnA为?(填序号).
a.一元强酸? b. 一元弱酸? c. 二元强酸? d. 二元弱酸
(3)某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:回答下列问题:

ⅰ.从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有?溶液的烧杯中,充分搅拌后经过滤、洗涤可得纯净的Mg(OH)2。
ⅱ .过程③的转化需要在HCl气流中加热,HCl的作用是?
.过程③的转化需要在HCl气流中加热,HCl的作用是?
ⅲ.写出过程④中发生反应的化学方程式?
参考答案:
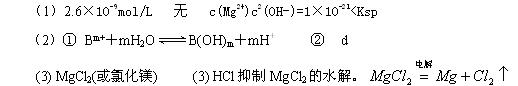
本题解析:略
本题难度:一般
5、选择题 已知0.1 mol/L的醋酸溶液中存在电离平衡:? CH3COOH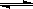 CH3COO-+H+?要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是(? )。
CH3COO-+H+?要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是(? )。
A.加少量CH3COONH4固体
B.降低温度
C.加少量NaOH固体
D.加水稀释
参考答案:D
本题解析:略
本题难度:简单