微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于氯水的叙述,不正确的是
A.新制氯水中只含有Cl2和H2O分子
B.加入AgNO3溶液有白色沉淀产生
C.光照氯水有气泡逸出,久置的氯水,酸性增强
D.饱和氯水与石灰石的反应是制取较浓HClO溶液的重要方法
参考答案:A
本题解析:A、新制氯水含有Cl2分子、H2O分子、HClO分子,错误;B、氯水中含有Cl?,加入AgNO3溶液,有白色沉淀AgCl产生,正确;C、光照氯水时,HClO分解生成O2,有气泡逸出,久置的氯水逐渐转化为HCl,酸性增强,正确;D、饱和氯水存在平衡:Cl2+H2O  HCl+HClO,加入石灰石后,HCl与CaCO3反应浓度减小,使平衡向右移动,HClO浓度增大,正确。
HCl+HClO,加入石灰石后,HCl与CaCO3反应浓度减小,使平衡向右移动,HClO浓度增大,正确。
本题难度:一般
2、选择题 几位同学想用实验的方法,通过自己的亲身观察证明这样一个事实:氯气通入水中能发生反应,但没有全部转化为HClO和HCl。你认为下列相关说法正确的是
A.向新制的氯水中加KI淀粉溶液即可证明
B.向久置失效的氯水中加KI淀粉溶液即可证明
C.直接观察氯水溶液仍显黄绿色即可说明,不需进一步实验
D.用实验证明干燥的氯气不能使干燥的有色布条褪色,能使湿润的有色布条褪色
参考答案:C
本题解析:A项错误,氯水中的氯气和HClO均能将I-氧化为碘单质,从而使淀粉变蓝;B项错误,此操作将不会产生明显的现象,无法证明;C项正确,氯水呈现氯气的黄绿色,足以证明氯气是否仍有存在(HCl或HClO 溶液均是无色的);D项错误,布条褪色只证明HClO存在,不能证明氯气是否存在。
本题难度:简单
3、选择题 在含有FeBr2和FeI2的混合溶液中通入过量Cl2,然后把这些溶液蒸干,并将残渣灼烧,最后留下来的固体是……(?)
A.Fe(OH)3
B.FeCl3
C.I2
D.Fe2O3
参考答案:D
本题解析:当溶液中通入过量Cl2时,2FeI2+3Cl2=2FeCl3+2I2,2FeBr2+3Cl2=2FeCl3+2Br2,所得FeCl3溶液加热蒸发时水解:FeCl3+3H2O=Fe(OH)3+3HCl↑,蒸干将残渣灼烧:2Fe(OH)3=Fe2O3+3H2O,最后所得固体为Fe2O3。
错误思路及分析:容易错选A或C,错选A的原因是只考虑了FeCl3溶液加热发生水解,忽视难溶的Fe(OH)3灼烧时发生分解;错选C是忽视了受热时碘的升华。
本题难度:一般
4、填空题 我校化学兴趣小组的学生对某品牌的消毒液的成分和性质进行实验探究:
①该消毒液外观无色透明,取适量滴加AgNO3溶液生成白色沉淀(该沉淀不溶于硝酸);
②用干燥洁净玻璃棒蘸取消毒液,点到pH试纸上,试纸先变蓝后褪色;
③取适量消毒液,滴加稀硫酸后,有黄绿色气体生成;
④用洁净铂丝蘸取消毒液,在无色灯焰上灼烧,火焰呈黄色。
⑤取适量消毒液,通入少量H2S气体,先看到有“浅黄色沉淀”,后又“澄清”。取澄清溶液适量,滴加BaCl2溶液,有白色沉淀生成(该沉淀不溶于盐酸)。
请回答以下问题:
(1)该消毒液的主要成分是_______________________________________。
(2)pH试纸颜色的变化说明消毒液溶液具有的性质是? _________________。
(3)实验③中的离子方程式为_______________________________________。
(4)实验⑤中,有“浅黄色沉淀”生成时的离子方程式为_________________________,又“澄清”时的离子方程式为__________________________________________。
参考答案:(1)NaCl和NaClO;
(2)碱性,漂白性;
(3)Cl-+ClO-+2H+=Cl2↑+H2O
(4)H2S+ClO-=S↓+Cl-+H2O;S+3ClO-+2OH-=SO42-+3Cl-+H2O(或S+3ClO-+H2O=SO42-+3Cl-+2H+)
本题解析:该消毒液外观无色透明,取适量滴加AgNO3溶液生成白色沉淀(该沉淀不溶于硝酸),证明含有Cl-;用干燥洁净玻璃棒蘸取消毒液,点到pH试纸上,试纸先变蓝后褪色,证明溶液呈碱性、有氧化性;消毒液滴加稀硫酸后,有黄绿色气体生成,证明有氧化性的微粒是ClO-;该消毒液焰色反应呈黄色,说明含Na+;向该消毒液中通入少量H2S气体,先看到有“浅黄色沉淀”,后又“澄清”。取澄清溶液适量,滴加BaCl2溶液,有白色沉淀生成(该沉淀不溶于盐酸)。说明先生成不溶于水的S单质,然后S单质又被氧化成SO42-。得到既不溶于水也不溶于酸的BaSO4沉淀。
本题难度:一般
5、实验题 二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题。
(1)实验室可由多种途径制取SO2。
途径I:Na2SO3固体与较浓的硫酸(约70%)反应制取;
途径II:铜与浓硫酸加热制取。
如果要在实验室制取SO2,选用上述两种方法中的?(填“途径I”或“途径II”)更合理,你的理由是?(答出一点就可)。
(2)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。
已知:2 KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+8H2O。装置B、C、D的作用分别是:
B:?;
C:?;
D:?。
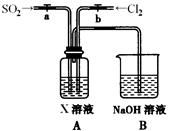
(3)某同学设计用如下装置探究二氧化硫、氯气的化学性质。

通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:
①若关闭b,打开a,若X为品红溶液,则A中的现象为:?,说明二氧化硫具有?性。
②若关闭a,打开b,若X为紫色石蕊试液,则A中的现象为:?,原因是?。
③若同时打开a、b,且通入的气体体积比为1:1,若X为紫色石蕊试液,则A中的现象为?,与②现象不同的原因是?(书写相应的化学方程式)。
参考答案:(1)途径I(1分)?制备等量的二氧化硫消耗的硫酸少(合理即可) (1分)
(2)B:向上排空气收集氯气(1分)
C:安全瓶作用:防止D中的液体倒吸进入集气管B中(1分)
D:吸收尾气,防止氯气扩散到空气中污染环境(1分)
(3)①溶液红色褪去(1分)?漂白(1分)
②溶液紫色先变红,后褪色(1分)氯气与水反应生成的盐酸使紫色变为红色,同时生成的HClO具有漂白性,使溶液红色褪去(2分)
③溶液由紫色变为红色(1分) ?Cl2+SO2+2H2O=2HCl+H2SO4(2分)
本题解析:(1)途径I的反应为Na2SO3+H2 SO4 =SO2+Na2SO4+ H2O ,途径II反应为Cu+2H2SO4(浓) =△= CuSO4+SO2↑+ 2H2O,由两反应可知生成等量的SO2 途径I需要的浓硫酸少。
由图可知B装置为收集装置,氯气的密度比空气的密度大,故作用为向上排空气收集氯气。C装置为防止D装置中的溶液进入C中,D中氢氧化钠溶液吸收氯气。(3)①SO2具有漂白性,能使品红褪色
②氯气与水反应生成的盐酸使紫色变为红色,同时生成的 HClO 具有漂白性,使溶液红色褪去
③通入的气体体积比为1:1二者恰恰完全反应 Cl2+SO2+2H2O=2HCl+H2SO4生成的酸使溶液由紫色变为红色2和SO2 的制法及化学性质
本题难度:一般