|
高考化学必考知识点《氯及其化合物》高频考点巩固(2017年模拟版)(四)
2017-08-26 01:55:23
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如下图所示。

请回答下列问题:
(1)A 中发生反应的化学方程式为?
(2)B中选用的试剂是饱和食盐水,其作用是除去Cl2中的杂质?;C中选用的试剂是?,其作用是除去Cl2中的?
(3)E装置发生反应的离子方程式是?
(4)用含HCl 14.6g的浓盐酸与足量的MnO2反应产生氯气的物质的量应______0.1mol(填大于、小于或等于)
参考答案:(10分)(1)MnO2+4HCl(浓) MnCl2+Cl2↑+ H2O MnCl2+Cl2↑+ H2O
(2)HCl?浓硫酸?水蒸气
(3)Cl2+2OH-==Cl- +ClO- + H2O?
(4)<
本题解析:(1)A装置是制取Cl2,化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+ H2O。 MnCl2+Cl2↑+ H2O。
(2) 饱和食盐水除去HCl;C装置的作用是干燥Cl2,用的是浓硫酸,其作用是除去Cl2中的水蒸气。
(3)E装置是吸收多余的Cl2,离子方程式是Cl2+2OH-==Cl- +ClO- + H2O。
(4)反应过程中浓盐酸的浓度越来越稀,就不反应生成Cl2,故用含HCl 14.6g的浓盐酸与足量的MnO2反应产生氯气的物质的量应小于0.1mol。
点评:本题考查了气体的制取、净化、检验、收集、尾气处理装置,制取气体的反应装置类型有:固体、固体加热型,如制取氨气;固体、液体加热型,如制取氯气;固体、液体不加热型,如制取氢气等,根据反应物的状态、条件选择不同的反应装置。
本题难度:一般
2、选择题 用如图所示装置进行下列实验,放置一段时间后,实验结果与预测的现象不一致的是( )
| ①中的物质 | ②中的物质 | 预测现象
A
浓盐酸
浓氨水
装置内出现白烟
B
酚酞溶液
浓硝酸
①中溶液变红
C
淀粉KI溶液
饱和氯水
①中溶液变蓝
D
饱和硫酸铜溶液
浓硫酸
①中溶液析出蓝色晶体
|
A.A
B.B
C.C
D.D
| 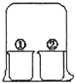
参考答案:A.浓盐酸和浓氨水都具有挥发性,挥发出的氯化氢和氨气相遇生成白烟氯化铵,所以装置内出现白烟,故A正确;
B.浓硝酸具有挥发性,硝酸溶于水得稀硝酸溶液,酚酞遇稀硝酸不变红,故B错误;
C.饱和氯水挥发出氯气,氯气能和碘化钾反应生成碘,碘遇淀粉变蓝色,所以①中溶液变蓝,故C正确;
D.浓硫酸具有吸水性,能吸收饱和硫酸铜溶液中的水分,导致硫酸铜溶液过饱和而析出五水硫酸铜晶体,故D正确;
故选B.
本题解析:
本题难度:简单
3、填空题 通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+====I2+Z+H2O常作为Y的鉴定反应。
(1)Y与Z的关系是(选填字母)______________________。
a.同位素? b.同系物
c.同素异形体? d.同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法:________________________________________________________。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示):________________。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,其结构式是___________________________。
②KCN溶液显碱性,原因是(用离子方程式表示)____________________________________。
(5)加热条件下,足量的Z与某金属M的盐MCR3(C为碳元素)完全反应生成CR2和MmRn(m、n均为正整数)。若CR2质量为w1 g,MmRn质量为w2 g,M的相对原子质量为a,则MmRn中m∶n=______________________(用含w1、w2和a的代数式表示)。
参考答案:(1)c
(2)加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2;若溶液不变红,则原通入气体是O3
(3)2Fe+3Cl2 2FeCl3、Fe+S 2FeCl3、Fe+S FeS(其他合理答案均可) FeS(其他合理答案均可)
(4)①H—C≡N
②CN-+H2O HCN+OH- HCN+OH-
(5)16w1∶(44w2-aω1)
本题解析:X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外),X是Cl2,反应Y+2I-+2H+====I2+Z+H2O,Y是由氧元素组成的单质,可能是O3、O2,能发生上面反应的Y是O3、Z是O2。(1)由同一元素组成的性质不同的几种单质叫做同素异形体。(2)SO2、O3都具有漂白性,但其漂白原理不同。SO2是与有机色质发生化合而褪色,是暂时性的,加热会恢复原有的品红颜色,而O3是发生强氧化还原反应而褪色,是永久褪色,不恢复。(3)比较氧化性强弱的方法很多,置换、与同金属反应价态的高低等。(4)利用化学键知识可以得到答案。KCN溶液显碱性是由于水解消耗H+产生OH-所致,得到CN-+H2O HCN+OH-。 HCN+OH-。
(5)2mMCO3+(n-m)O2 2mCO2+2MmOn 2mCO2+2MmOn
w1 ?g? w2 g
列式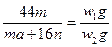 ,结果为16w1∶(44w2-aw1)。 ,结果为16w1∶(44w2-aw1)。
本题难度:简单
4、选择题 三氯化氮分子中每个原子的最外层均达到8电子稳定结构,且氮与氯的共用电子对偏向氮原子。则下列关于三氯化氮的叙述正确的是(? )
A.NCl3为非极性分子
B.NCl3跟水反应的产物为NH3和HClO
C.NCl3跟水反应生成NH4Cl、O2和Cl2
D.在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl
参考答案:B
本题解析:因氮与氯的共用电子对偏向氮原子,则在NCl3中,N显-3价,Cl显+1价,则其发生水解的方程式应为:NCl3+3H2O====NH3+3HClO。又因氨气分子的空间构型推知NCl3为三角锥形结构,为极性分子。
本题难度:简单
5、实验题 用化学方法测定微量碘化物时,必须利用“化学放大”反应将碘的量“放大”,然后再进行测定。下面是“化学放大”反应的实验步骤:
①向含微量I-并且呈中性或弱酸性溶液里加入溴水,将I-完全氧化成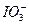 ,煮沸去掉过量的Br2; ,煮沸去掉过量的Br2;
②向由①制得的水溶液中加入过量的酸性KI溶液,振荡使反应进行完全;
③在②得到的水溶液中加入足量的CCl4,振荡,把生成的I2从水溶液里全部转移到CCl4中,用分液漏斗分液去掉水层;
④向③得到的CCl4层加入肼(即联氨H2N—NH2)的水溶液,振荡,使I2完全以I-形式从CCl4层进入水层,用分液漏斗分液去掉CCl4层。
经过以上四步得到的水溶液里,含有通过反应而“放大”了的碘,请回答下列问题:
(1)写出步骤②的离子方程式,并标出下列反应的电子转移的方向和数目:_______________________。

(2)将右图所示的分液漏斗中的下层液体放出的操作步骤为:
①___________________________________________。
②旋开活塞,使下层液体流出到一个烧杯里,当下层液体全部流出活塞的细孔时,__________________。
③从漏斗上口倒出上层液体。
④旋开活塞,将留在颈部的下层液体放出到盛接下层液体的烧杯里。
(3)若忽略实验过程中出现的损失,经过一次“化学放大”的溶液里,I-的量是原溶液里I-的量的____________倍。经过n次“化学放大”的溶液里,I-的量是原溶液里的量的________倍。
参考答案:

(2)①取下漏斗口上的塞子 ②迅速关闭活塞
(3)6 ?6n
本题解析:考查氧化还原和萃取分液的实验操作。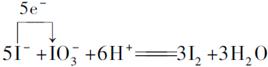 ,经过该反应得到的I2又和H2N—NH2发生氧化还原反应生成I-,这样得到的I-是原来的6倍,所以经过n次“化学放大”的溶液里,I-的量是原溶液里的量的6n倍。 ,经过该反应得到的I2又和H2N—NH2发生氧化还原反应生成I-,这样得到的I-是原来的6倍,所以经过n次“化学放大”的溶液里,I-的量是原溶液里的量的6n倍。
本题难度:简单
| 