微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 1gH2完全燃烧生成液态水放出142.9KJ热量,下列反应的热化学方程式正确的是
A.H2 + O2=2H2O △H= -571.6KJ/mol
B.H2 (g)+1/2O2(g)= H2O (l) △H= -142.9KJ/mol
C.H2 (g)+1/2O2(g)= H2O (l) △H= -285.8KJ/mol
D.2H2 (g) + O2(g) = 2H2O (g) △H=" -571.6KJ/mol"
参考答案:C
本题解析:略
本题难度:简单
2、填空题 (6分)氨在国民经济中占有重要的地位,请参与下列探究
(1)已知在400℃时,2NH3(g) N2 (g)+ 3H2(g) (△H>0)的平衡常数K=2,
N2 (g)+ 3H2(g) (△H>0)的平衡常数K=2,
①400℃时,N2 (g)+ 3H2(g) 2NH3(g)的K=?(填数值)。
2NH3(g)的K=?(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(NH3)正?V(NH3)逆(填:>、<、=、不能确定)。
(2)已知: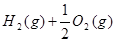 =H2O(l)?△H=—285.8 kJ·
=H2O(l)?△H=—285.8 kJ· ?…①
?…①
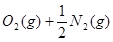 ?=NO2(g)?△H=+33.9 kJ·
?=NO2(g)?△H=+33.9 kJ· ?…②?
?…②?
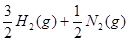 ?=NH3(g)?△H=—46.0 kJ·
?=NH3(g)?△H=—46.0 kJ· ?…③
?…③
H2O(l)=H2O(g)?△H=+44 kJ· ?…④
?…④
则表示NH3燃烧热的热化学方程式为?
参考答案:(1)①? 1/2?;②?=
(2)NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol
本题解析:(1)①根据平衡常数的表达式可知,逆反应的平衡常数是正反应的平衡常数的倒数,因此K=0.5。
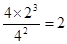 ②此时N2、H2、NH3的物质的量浓度分别是(mol/L)4、2、4,所以?,因此正逆反应速率相等。
②此时N2、H2、NH3的物质的量浓度分别是(mol/L)4、2、4,所以?,因此正逆反应速率相等。
(2)燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以根据盖斯定律可知,①×3/2-③即得到NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l),所以反应热是—285.8 kJ· ×1.5+46.0 kJ·
×1.5+46.0 kJ· =-382.7 kJ/mol,所以热化学方程式为NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol。
=-382.7 kJ/mol,所以热化学方程式为NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol。
本题难度:一般
3、选择题 区别强弱电解质的标准是(? )
A.化合物水溶液的导电性
B.在水中化合物的溶解度
C.化合物在水溶液中的电离程度
D.化合物溶于水后是否与水反应生成能电离的物质
参考答案:C
本题解析:本题考查学生对概念的理解。强电解质电离程度大,完全或基本完全电离;弱电解质电离程度小。
本题难度:简单
4、选择题 下列反应既是氧化还原反应又是放热反应的是(?)
A.过氧化钠与水反应
B.氨水与稀硫酸的反应
C.灼热的炭与CO2反应
D.Ba(OH)2·8H2O与NH4Cl 的反应
参考答案:A
本题解析:A.过氧化钠与水反应既是氧化还原反应又是放热反应,正确。B.氨水与稀硫酸的反应是复分解反应,不属于氧化还原反应,是放热反应;错误。C.灼热的炭与CO2反应是氧化还原反应,但是是吸热反应。错误。D.Ba(OH)2·8H2O与NH4Cl 的反应是复分解反应,不属于氧化还原反应,是吸热反应;错误。
本题难度:简单
5、选择题 下列图中能正确表示X + 3Y = 2Z(放热反应)过程的能量变化的是:
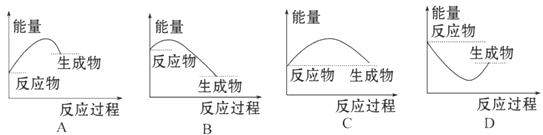
参考答案:B
本题解析:A.由于生成物的能量比反应物高,所以该反应为吸热反应。错误。B.由于反应物的能量比生成物高,所以该反应为放热反应。正确。C。由于反应物、生成物的能量相同,所以反应过程中无能量变化。错误。D.化学反应的过程就是旧键断裂、新键形成的过程。断裂化学键要吸收能量。这与图像画的不符合。错误。
本题难度:简单