| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《能量的相互转化》试题强化练习(2017年最新版)(四)
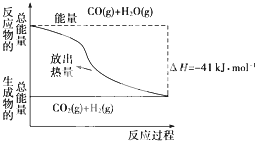 参考答案:A、从图示可知,反应物能量高生成物能量低,所以该反应为放热反应,从反应热为“-”也可知此反应为放热反应,故A错误; 本题解析: 本题难度:简单 2、选择题 “中和热”是一个在热化学中的重要概念,“中和热”的定义为:在稀溶液中,酸跟碱发生中和反应则生成1mol H2O,这时的反应热叫做中和热。以下关于中和热的叙述正确的是(? ) 参考答案:B 本题解析:略 本题难度:简单 3、填空题 (15分)为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。 |
 的HCOONa溶液pH =10,则HCOOH的电离常数
的HCOONa溶液pH =10,则HCOOH的电离常数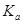 =_________。
=_________。参考答案:
(1)-746.5(3分)
(2)①4.4×10-3(2分)? D(1分)?②22.2%(2分)3.4(2分)
(3)2c(SO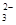 )+c(HSO
)+c(HSO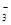 )(2分)
)(2分)
(4)1.0×10-7(3分)
本题解析:
(1)①? N2(g)+O2(g)=2NO(g)?△H=+180.5kJ·mol-1
?②? 2C(s) +O2(g)=2CO2(g)?△H=-787kJ·mol-1
③ 2CO(g) +O2(g)=2CO2(g)?△H=-566kJ·mol-1
③-①得:
2NO(g+2CO(g)=N2(g)+2CO2(g))?△H=-746.5kJ·mol-1
(2)?①在前九秒钟浓度减少了0.04mol/L,所以v(CO)=4.4×10-3;该反应的正向是放热反应,A升高温度向吸热的方向移动,一氧化碳和一氧化氮的浓度应该升高,错误;B加入一氧化氮时,一氧化氮的浓度应该是先升高再降低,图中不符,错误;C加入催化剂,不会影响化学平衡,也就是说一氧化碳和一氧化氮的浓度不会发生变化。错误;D降低温度,平衡正向移动,符合图中的曲线变化,正确。?
②? 2NO(g?+? 2CO(g)?=? N2(g)?+? 2CO2(g)
起始:0.2mol? 0.1mol? 0?0
变化:2x mol? 2x mol? x mol? 2x mol
平衡:(0.2-2 x)?(0.1-2 x)? x mol? 2x mol
由题意得:(0.2-2 x)=0.14?所以x="0.03" mol
该反应在第24 min时达到平衡状态,CO2的体积分数为: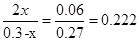 ?
?
化学平衡常数为:
(3)Na2SO3和NaHSO3混合溶液中遵循电荷守恒:
c(Na+)+c(H+)=2c(SO42-)+c(HSO4-)+c(OH-),又因为是中性溶液,有:c(H+)=c(OH-)
所以:c(Na+) =2c(SO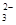 )+c(HSO
)+c(HSO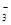 )(2分)
)(2分)
HCOO-?+H2O 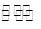 ?HCOOH?+? OH-?
?HCOOH?+? OH-?
起始:0.1mol/L? 0? 0
变化:0.0001mol/L? 0.0001mol/L? 0.0001mol/L
平衡:(0.1-0.0001)mol/L? 0.0001mol/L? 0.0001mol/L
所以该反应的水解平衡常数:Kh=1.0×10-7〔 (0.1-0.0001)mol/L近似等于0.1mol/L〕
又根椐
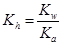 ,所以
,所以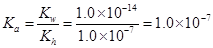

本题难度:一般
4、填空题 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图,然后回答问题.
(1)图中反应是______(填“吸热”或“放热”)反应.
(2)对于同一反应,图中虚线( II)与实线( I)相比,改变的条件是______,对反应热是否有影响?______,原因是______.
(3)已知?C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
CO(g)+
| 1 2 |
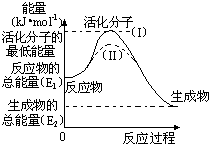
参考答案:(1)依据图象分析反应物的能量大于生成物的能量,反应放热,故答案为:放热;
(2)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,化学反应速率影响因素中,催化剂有此作用,所以最有可能使用了催化剂,反应热不变,反应热只与反应物和生成物的始态有关,故答案为:催化剂;?无/没影响;反应热只与反应物和生成物的始态有关/催化剂只改变活化能;
(3)已知:(1)C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
(2)CO(g)+12O2(g)=CO2(g);△H=-283.0kJ/mol
利用盖斯定律,将(1)-(2),可得?C(s)+12O2(g)=CO(g),
则:△H=-393.5kJ/mol-(-283.0kJ/mol)=-110.5KJ/mol.
C(s)与O2(g)反应生成CO(g)的热化学方程式C(s)+12O2(g)=CO(g)的△H=-110.5?kJ/mol,故答案为:C(s)+12O2(g)=CO(g)的△H=-110.5?kJ/mol;
本题解析:
本题难度:简单
5、实验题 利用如图所示装置测定中和热的实验步骤如下: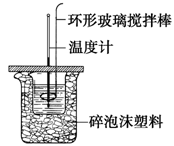
步骤一:用量筒量取50ml 0.50 mol?L-1盐酸倒入小烧杯中,测出盐酸温度t1;
步骤二:用另一量筒量取50ml 0.55 mol?L-1 NaOH溶液,并用另一温度计测出其温度t2;
步骤三:将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度t3。
回答下列问题:
(1)步骤三中倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入? B.分三次少量倒入? C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.轻轻地振荡烧杯? B.揭开硬纸片用玻璃棒搅拌
C.用温度计小心搅拌?D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)___________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,理由是________________________________________。
(4)在反应中若因为有放热现象,而造成少量HCl在反应中挥发,则测得的中和热_______(填“偏大”、“偏小”或“不变”)。
参考答案:(1)C?(2)D
(3)不能, 因为硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热。(4) 偏小
本题解析:(1)在中和热的测定实验中,加热氢氧化钠的次数越多,损失的热量越多。因此步骤三中倒入NaOH溶液的正确操作是一次迅速倒入,答案选C。
(2)A、轻轻地振荡烧杯容易使液体溅出,A不正确;B、揭开硬纸片用玻璃棒搅拌容易使热量损失,B不正确;C、温度计只能测量温度,不能用来搅拌,C不正确;D、用套在温度计上的环形玻璃搅拌棒轻轻地搅动属于正确的操作,D正确,答案选D。
(3)由于硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热。
(4)在反应中若因为有放热现象,而造成少量HCl在反应中挥发,则导致热量减少,因此测得的中和热偏小。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《原电池原理.. | |