|
高考化学试题《物质组成与性质实验方案的设计》试题预测(2017年最新版)(十)
2017-08-26 02:04:54
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 (8分)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____________,滴定终点的判断方法是________________________。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是?.
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
| (3)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为_______mL.
参考答案:(8分,每空2分)
(1)锥形瓶内溶液颜色变化 ?溶液颜色由黄色变为橙色且半分钟不褪色
(2)D? (3) 25.90
本题解析:略
本题难度:一般
2、选择题 在生活、生产及化学研究中,人们经常需要根据不同原子、分子或离子的某些特征反应对物质进行区别、检验等.下列说法正确的是( )
A.用KOH溶液可以将(NH4)3PO4、NaBr、CuSO4、AlCl3区别开
B.MnO2、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开
C.某溶液中加入稀盐酸有无色气体产生,该气体能使澄清石灰水变浑浊,则此溶液中一定含有CO32ˉ
D.可以用BaCl2溶液和稀硝酸检验Na2SO3是否变质
参考答案:A、氢氧化钾和磷酸铵共热会生成具有刺激性气味的气体氨气,和溴化钠不反应,没有现象,和硫酸铜反应生成蓝色沉淀,和氯化铝反应会产生白色沉淀,现象各不相同,故A正确;
B、MnO2、CuO、Fe三种物质的粉末都是黑色的,二氧化锰和稀盐酸不反应,和氧化铜反应得到蓝色溶液氯化铜,和金属铁反应生成浅绿色溶液氯化亚铁并放氢气,现象各不一样,故B正确;
C、能使石灰水变浑浊的气体有二氧化碳、二氧化硫,某溶液中加入稀盐酸使澄清石灰水变浑浊的气体产生,所以此溶液中可以含有碳酸根、碳酸氢根、亚硫酸根或亚硫酸氢根中的至少一种,故C错误;
D、亚硫酸钠可以和氯化钡反应生成亚硫酸钡,是白色不溶于水的白色沉淀,该沉淀可以被硝酸氧化为硫酸钡,Na2SO3是变质还是没变质用BaCl2溶液和稀硝酸检验结果是一样的,故D错误.
故选AB.
本题解析:
本题难度:一般
3、实验题 向草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色总是先慢后快。某研究性学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验探究其原因:
实验(1):在两支试管中分别加入10mL等浓度的草酸溶液,在②号试管中加入少量硫酸锰固体。然后在两支试管中分别加入5滴0. 1mol.L-1的硫酸酸化高锰酸钾溶液。现象如表1。
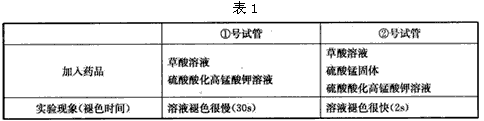
实验(2):在两支试管中分别加入5mL等浓度的草酸溶液,在②号试管中再滴加10滴稀硫酸,然后各加入5 滴0. 1mol.L-1的高锰酸钾溶液。现象如表2。
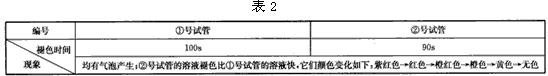
实验(3):取3支试管分别加入5mL等浓度草酸溶液,然后在①、②、③号试管中依次加入10滴、1mL、2mL稀硫酸溶液,各加入5滴0. 1mol.L-1的高锰酸钾溶液,然后置于温度为65℃的水浴中加热。观察现象如表3。

(1)该研究性学习小组的实验目的是___。
(2)该研究性学习小组进行实验时所用的方法是科学实验中常用的一种方法,该方法叫____法;
(3)实验(1)得出的结论是____。
(4)由实验(2)和实验(3)得出的结论是(写三点)____,____,____?
(5)据有关现象写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:
___H2C2O4+___MnO4-+____H+==____Mn2++____CO2↑+___H2O
参考答案:(1)研究温度、浓度、催化剂等因素对化学反应速率的影响
(2)对照实验法或者控制变量法
(3) Mn2+在反应中起到催化剂的作用,加快了反应速率
(4)加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应;加入大量硫酸,草酸和高锰酸钾溶液的反应速率比较慢;温度升高,反应速率加快
(5)5 ;2; 6 ;2 ;10; 8
本题解析:
本题难度:一般
4、实验题 (10分)中学化学中几种常见物质的转化关系如下:(提示:A单质有可变价态且与硫反应生成低价态)

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体F粒子直径大小的范围:________。
(2)B的化学式:________。
(3)写出:D的溶液与氨水反应的离子方程式:
________________________________________________________________________;
C的溶液与双氧水反应的离子方程式:
________________________________________________________________________。
(4)写出鉴定E中阳离子的实验方法和现象:
________________________________________________________________________。
参考答案:(1)1~100 nm
(2)FeS
(3)Fe3++3NH3·H2O===Fe(OH)3↓+3NH 2Fe2++H2O2+2H+===2Fe3++2H2O
(4)取少量E溶液于一试管中,加入适量浓NaOH溶液,加热产生的气体能使湿润的红色石蕊试纸变蓝色,则证明溶液中含NH?
本题解析:由F为Fe(OH)3知A为Fe,B为FeS,C为FeSO4,D为Fe2(SO4)3,E为(NH4)2SO4。
本题难度:一般
5、实验题 (10分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的试验。回答下列问题:
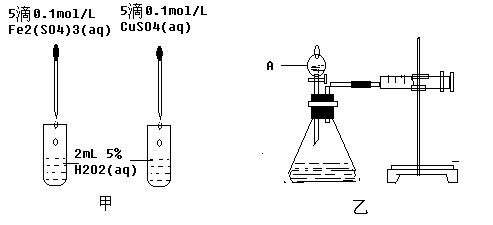
(1)?定性分析:如图甲可通过观察?,定性比较得出结论。写出H2O2在二氧化锰作用下发生反应的化学方程式:?。
(2)?定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为?,实验中需要测量的数据是?。检查乙装置气密性的方法是?。
参考答案:

本题解析:略
本题难度:简单
| 