| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《电解池原理》考点预测(2017年强化版)(十)
参考答案: 本题解析: 本题难度:一般 2、选择题 如图所示a、b 都是惰性电极,通电—段时间后,a极附近溶液显红色。下列说法中正确的是(? )。 参考答案:B 本题解析:该装置为电解装置,a极显红色,说明a极氢氧根离子浓度增大,氢离子浓度减小,所以a极氢离子放电,则a极为阴极,b极为阳极,Y为正极X为负极,A错误;B正确;因此铂极为阴极,铜离子放电成为单质铜,铜极为阳极,铜放电成为铜离子进入溶液,所以CuSO4溶液的浓度基本不变,pH基本不变,C、D错误,答案选B。 本题难度:简单 3、选择题 设NA表示阿伏加德罗常数,下列叙述正确的是 ( ) |
参考答案:A
本题解析:A、氯气被还原作氧化剂时,氯元素化合价从0价降低到-1价,因此1分子氯气得到2个电子,所以71g氯气即1mol氯气被还原得到的电子数为2NA,A正确;B、碳酸钠溶于水碳酸根水解,所以100 mL l mol·L-1的碳酸钠溶液中含有的CO32-数小于0.1NA,B错误;C、标准状况下苯不是气态,不能适用于气体摩尔体积,C错误;D、电解精炼铜时阴极铜离子放电,即Cu2++2e-=Cu,所以当阴极析出64 g金属时阳极失去的电子数等于2NA,D错误,答案选A。
考点:考查阿伏伽德罗常数的计算
本题难度:一般
4、选择题 加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。下列说法正确的是
[? ]
A.a电极是阴极
B.a极区的KI最终转变为KIO3
C.阳极电极反应:4OH--4e-==2H2O+O2↑
D.电解过程中OH-从a极区通过离子交换膜c进入b极区
参考答案:B
本题解析:
本题难度:一般
5、选择题 如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16 g,乙池中某电极上析出0.24 g某金属,下列说法正确的是
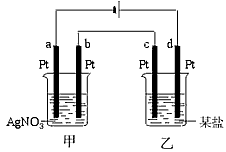
[? ]
参考答案:C
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《金属材料》.. | |