微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 亚硝酸(HNO2)的下列性质中,可以证明它是弱电解质的?(?)
A.1molL-1亚硝酸溶液的c(H+)约为1×10-2mol·L-1
B.亚硝酸能与水以任何比例互溶
C.10mL、1mol·L-1亚硝酸恰好与10mL、1mol·L-1NaOH溶液完全反应
D.亚硝酸溶液的导电性比强酸溶液的弱
参考答案:A
本题解析:弱电解质溶于水只能部分电离,若1mol·L-1HNO2溶液完全电离,则c(H+)=1mol·L-1,现在c(H+)=1×10-2mol·L-1,说明只部分电离,A正确;B选项只叙述了HNO2在水中的溶解性;C选项只说明HNO2具有酸性,未涉及酸性的强弱。D选项未指明条件,故溶液导电性弱仅说明溶液中离子浓度小,不能说明是否是部分电离。
本题难度:一般
2、填空题 (12分)氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。
(1)三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为 。
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为 ;该工艺选择氯气的优点是 。(答一点即可)
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为1×10-3 mol,则理论上生成的SO42-为 mol。
(4)生产和实验中广泛采用甲醛法测定样品的含氮量。甲醛和铵根离子的反应如下:
4NH4+ + 6HCHO =(CH2)6N4H+(一元酸)+ 3H+ + 6H2O
实验步骤如下:
①已知甲醛溶液中常含有甲酸。取b mL甲醛溶液(过量)于锥形瓶,加入1滴酚酞,用浓度为c mol/L的NaOH溶液中和,滴定管的初始读数V1 mL,当溶液呈微红色时,滴定管的读数V2 mL。
②向其中加入饱和食盐水试样a mL,静置数分钟。
③再加1~2滴酚酞,再用上述NaOH溶液滴定至微红色,滴定管的读数V3 mL。
则饱和食盐水中的含氮量为 mg/L。
参考答案:(12分)
(1)HClO(2分)
(2)3Cl2 + 2NH4++ 8OH- = N2↑+ 6Cl- + 8H2O。(2分)
利用氯碱工业的产品氯气为原料,就近取材;不引入其他杂质离子。(2分)
(3)5×10-4(3分)
(4)14000C(V3—V2)/a mg/L (3分)
本题解析:(1)三氯化氮水解产生氨气,说明N原子与氢离子结合,所以Cl与氢氧根离子结合生成HclO;
(2)由题意可知,氯气与氨气反应,在碱性条件下生成氮气,则氯气被还原为氯离子,同时有水生成,离子方程式为3Cl2 + 2NH4++ 8OH- = N2↑+ 6Cl- + 8H2O;该过程选择氯气的原因是氯气本身是氯碱工业的产品,就近取材,同时氮气以气体放出,不会产生杂质离子;
(3)氯气被还原为氯离子,1×10-3 mol时转移电子的物质的量是2×10-3 mol,根据得失电子守恒,Na2S2O3在S的化合价是+2价,硫酸根中S的化合价是+6价,S的化合价升高4价,所以理论上生成的SO42-为2×10-3 mol/4=5×10-4mol;
(4)由题意可知,氢氧化钠滴定甲醛和铵根离子的反应产生的氢离子的物质的量是C(V3—V2) ×10-3 mol,由反应方程式得4NH4+~4 H+~4OH-,所以N的含量是C(V3—V2) ×10-3 mol×14g/mol/a×10-3 L=14000C(V3—V2)/a mg/L。
考点:考查反应在产物的判断,氧化还原反应规律的应用,滴定的计算
本题难度:困难
3、填空题 为防止环境污染和发生意外事故,实验过程中产生的废液不能随意倒入下水道。已知某次化学实验后,回收的废液中可能含有K+、Cu2+、Ag+等离子。
(1)为检验废水中是否含有Ag+,可以采用的试剂是 。如果溶液中确实存在Ag+,加入试剂后,将观察到的现象是
。
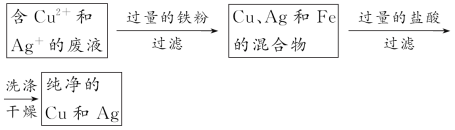
(2)实验证明,废液中确实存在上述三种离子。为回收Cu、Ag两种金属,实验时可以分别加入过量的 和 (填物质名称),充分反应后,经过 (填实验操作名称),可得到Cu和Ag。经过上述处理后的废水,进一步处理后即可以排放。
参考答案: (1)HCl(或盐酸盐) 有白色沉淀生成 (2)铁粉(或比铜活泼的金属) 稀盐酸 过滤
本题解析:(1)利用Ag+和Cl-反应生成不溶于稀硝酸或盐酸的AgCl白色沉淀来检验Ag+。
(2)回收Cu、Ag两种金属的流程如下:
考点:常见物质的检验、分离和提纯
本题难度:一般
4、选择题 在溶液中能大量共存的离子组是
A.Ba2+、HSO4-、Cl-、NO3-
B.Fe3+、NH4+、SCN-、OH-
C.OH-、Ag(NH3)2+、Na+、K +
D.HS-、Na+、ClO-、Fe2+
参考答案:C
本题解析:略
本题难度:简单
5、选择题 在密闭容器中进行X2(g)+4Y2(g)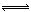 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是?
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是?
A.c(X2)="0.15" mol·L-1
B.c(Y2)="0.9" mol·L-1
C.c(Z2)="0.3" mol·L-1
D.c(Q2)="0.5" mol·L-1
参考答案:B
本题解析:该反应是可逆反应,所以反应物和生成物的浓度不可能是0,据此可知,B不正确,因为如果c(Y2)="0.9" mol/L,则需要消耗Z2、Q2的浓度分别是0.25mol/L和0.375mol/L,显然这是不可能的,答案选B。
点评:该题是高考中的常见题型,属于中等难度试题的考查,试题基础性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和应试能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确可逆反应的特点,然后灵活运用即可。
本题难度:简单