微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在强酸性溶液中能够大量共存的离子组是(?)
A.Na+、Cl-、Al3+、Ag+
B. 、Mg2+、
、Mg2+、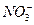 、
、
C.K+、Ca2+、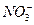 、
、
D. 、Na+、K+、
、Na+、K+、
参考答案:B
本题解析:在强酸性溶液中, 、
、 与H+作用产生气体,Cl-与Ag+作用产生沉淀。
与H+作用产生气体,Cl-与Ag+作用产生沉淀。
本题难度:简单
2、填空题 依据题目要求回答下列问题。
(1)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如表所示。
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
| C6H5ONa
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
| 11.3
|
①上述盐溶液中的阴离子结合H+能力最强的是?。?
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是?(填字母编号,下同);将各溶液分别稀释100倍,pH变化最小的是?。
A.HCN? B.HClO? C.C6H5OH? D.CH3COOH? E.H2CO3
③根据上表数据,请你判断下列反应不能成立的是?。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+NaClO=NaHCO3+HClO
D.CO2+H2O+2C6H5Ona=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为?。
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液中c(Cu2+)="0.02" mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于?。
参考答案:(1)①C ?②D? C?③D
?②D? C?③D
④Cl2+HC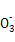
 CO2+Cl-+HClO(分步写成Cl2+H2O
CO2+Cl-+HClO(分步写成Cl2+H2O HClO+H++Cl-,H++HC
HClO+H++Cl-,H++HC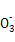
 CO2↑+H2O也可)
CO2↑+H2O也可)
(2)5
本题解析:(1)①根据“酸越弱,其酸根离子水解程度越大”理论由Na2CO3溶液的pH最大,可知C 的水解能力最强,所以C
的水解能力最强,所以C 结合H+的能力最强。②等物质的量浓度的NaCN、NaClO、C6H5ONa、CH3COONa、NaHCO3溶液,CH3COONa溶液的pH最小,CH3COONa的水解能力最弱,CH3COOH的酸性最强,C6H5OH的酸性最弱,C6H5OH电离能力最弱,稀释过程中溶液的pH变化也最小。③C6H5ONa溶液中通入CO2时生成的物质应该是NaHCO3而不是Na2CO3。
结合H+的能力最强。②等物质的量浓度的NaCN、NaClO、C6H5ONa、CH3COONa、NaHCO3溶液,CH3COONa溶液的pH最小,CH3COONa的水解能力最弱,CH3COOH的酸性最强,C6H5OH的酸性最弱,C6H5OH电离能力最弱,稀释过程中溶液的pH变化也最小。③C6H5ONa溶液中通入CO2时生成的物质应该是NaHCO3而不是Na2CO3。
(2)Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)=2×10-20=0.02×c2(OH-),解得c(OH-)=10-9 mol·L-1,要使Cu2+生成Cu(OH)2沉淀,则c(OH-)>10-9 mol·L-1,溶液的pH>5。
本题难度:一般
3、选择题 下列溶液中,能大量共存的离子组是( )
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10-13mol/L的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
参考答案:A.因该组离子之间不反应,能大量共存,故A正确;
B.c(H+)=1×10-13mol/L的溶液,显碱性,Ca2+、CO32-结合生成沉淀,则不能共存,故B错误;
C.因Fe3+、SCN-结合生成络离子,则不能共存,故C错误;
D.因H+、Fe2+、NO3-发生氧化还原反应,则不能共存,故D错误;
故选A.
本题解析:
本题难度:一般
4、选择题 某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO
、NO
B.Na+、SO、Cl-、S2-
C.NH、Mg2+、SO、NO
D.H+、K+、Cl-、Na+
参考答案:A.强碱溶液中不能大量存在HCO3-,故A错误;
B.碱溶液中该组离子之间不反应,能大量共存,故B正确;
C.碱溶液中不能大量存在NH4+、Mg2+,故C错误;
D.碱溶液中不能大量存在H+,故D错误;
故选B.
本题解析:
本题难度:简单
5、选择题 在KHSO4的水溶液及熔化两种状态下都能存在的离子是(?)
A.K+
B.H+
C.HSO4-
D.SO42-
参考答案:A
本题解析:物质熔化可破坏离子键,但不能破坏共价键,在水溶液中,可破坏离子键也可破坏强极性共价键。KHSO4熔化电离:KHSO4 K++ HSO4-?,水溶液电离:KHSO4
K++ HSO4-?,水溶液电离:KHSO4 K++H++ SO42-。
K++H++ SO42-。
本题难度:一般