| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《原电池原理》高频试题强化练习(2017年最新版)(八)
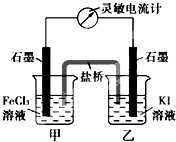 参考答案:A.当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,而乙中石墨成为正极,故A错误; 本题解析: 本题难度:一般 3、选择题 如图为一原电池的结构示意思,下列说法中,不正确的是( ) |

参考答案:A、该原电池放电时,较活泼的金属锌作负极,负极上锌失电子发生氧化反应,较不活泼的金属铜作正极,正极上铜离子得电子发生还原反应,所以电池反应式为:Zn+Cu2+=Zn2++Cu,且构成原电池的条件之一是:化学反应必须是能自发进行的氧化还原且放热的反应,该反应是一个放热反应,故A正确.
B、原电池工作时,较活泼的金属锌作负极,锌失去电子发生氧化反应,所以电子从锌极流出,故B正确.
C、原电池工作时,较不活泼的金属铜作正极,正极上铜离子得电子发生还原反应,所以正极上有铜单质析出导致
CuSO4溶液蓝色变浅,故C错误.
D、如果将Cu电极改为Fe电极,锌的金属性大于铁,所以Zn电极依然作负极,故D正确.
故选C.
本题解析:
本题难度:简单
4、选择题 高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是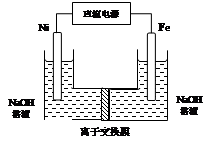
A.铁是阳极,电极反应为Fe-2e-+2OH-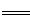 Fe(OH)2
Fe(OH)2
B.电解一段时间后,镍电极附近溶液的pH减小
C.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42-
D.每制得1mol Na2FeO4,理论上可以产生67.2L气体
参考答案:C
本题解析:用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4),铁失电子生成高铁酸钠,则铁作阳极,镍作阴极,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,所以电极反应式为Fe-2e-+2OH-═Fe(OH)2,故A正确;镍电极上氢离子放电生成氢气,氢离子浓度减小,所以溶液的pH增大,故B错误;若离子交换膜为阴离子交换膜,阴离子向阳极移动,则电解结束后右侧溶液中含有FeO42-,故C错误;温度和压强未知,所以无法计算生成气体体积,故D错误;故选A。
本题难度:简单
5、选择题 X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出(使用惰性电极);又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为
[? ]
A.X>Z>Y>M
B.X>Y>Z>M
C.M>Z>X>Y
D.X>Z>M>Y
参考答案:A
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《物质的分类.. | |