|
高中化学知识点大全《能量的相互转化》高频试题强化练习(2017年最新版)(六)
2017-08-26 02:21:09
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以下各反应中,生成物的总能量高于反应物的总能量的是(?)
A.甲烷燃烧
B.Ba(OH)2·8H2O与NH4Cl反应
C.铝片与盐酸反应
D.氧化钙与水反应
参考答案:B
本题解析:生成物的总能量高于反应物的总能量,这说明该反应是吸热反应,选项ACD都是放热反应,B是吸热反应,答案选B。
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识对巩固和训练,难度不大。该题的关键是记住常见的放热反应和吸热反应,即一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。
本题难度:简单
2、选择题 下列说法错误的是
A.已知298K时,2SO2(g)+O2(g)  2SO3(g) △H=-197kJ/ mol,对该热化学方程式理解为:在该条件下,向密闭容器中通入2摩SO2和1摩O2,达到平衡时放出热量是197 kJ 2SO3(g) △H=-197kJ/ mol,对该热化学方程式理解为:在该条件下,向密闭容器中通入2摩SO2和1摩O2,达到平衡时放出热量是197 kJ
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol
C.吸热反应是指反应物所具有的总能量低于生成物所具有的总能量,而不是看反应过程是否需要加热
D.对下列反应:HCl(aq) + NaOH(aq)="NaCl(aq)" + H2O(l)△H=-Q1kJ/mol
| 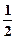 H2SO4(浓)+NaOH(aq)= H2SO4(浓)+NaOH(aq)= 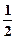 Na2SO4(aq)+H2O(l)?△H=-Q2kJ/mol Na2SO4(aq)+H2O(l)?△H=-Q2kJ/mol
上述反应均在溶液中进行,则Q2>Q1
参考答案:A
本题解析:略
本题难度:一般
3、填空题 (8分)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
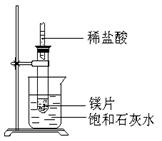
(1)实验中观察到的现象是?
?。
(2)产生该现象的原因?
(3)写出有关反应的离子反应方程式?
(4)由此推知,MgCl2溶液和H2的总能量??填(“大于”“小于”或“等于”)镁片和盐酸的总能量
参考答案:(1)向镁片表面产生气泡,逐渐减少;烧杯中有固体物质析出.
(2)镁跟盐酸反应产生氢气,并放出热量;Ca(OH)2的溶解度随温度的升高而变小.
(3)Mg+2H+═Mg2++H2↑ 2分?(4)小于
本题解析:镁是活泼的金属,和盐酸反应生成氯化镁和氢气。由于反应物的总能量高于生成物的总能量,因此是放热反应。由于反应放热,使溶液的温度升高。又因为Ca(OH)2的溶解度随温度的升高而变小,所以会析出氢氧化钙晶体。
本题难度:一般
4、填空题 ?(附加题1)用1 L 1.0 mol/LNaOH溶液吸收35.2 g CO2气体,溶液中CO32-与HCO3-的物质的量之比为1∶3;反应的化学方程式为_______________________________________。
参考答案:5NaOH + 4CO2=? 3NaHCO3?+? Na2CO3 + H2O
本题解析:35.2 g CO2气体是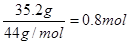 ,氢氧化钠是1.0mol ,氢氧化钠是1.0mol
即二者的物质的量之比是4︰5,而溶液中CO32-与HCO3-的物质的量之比为1∶3
所以方程式为5NaOH + 4CO2=? 3NaHCO3?+? Na2CO3 + H2O。
本题难度:简单
5、填空题 (16分)汽车尾气是城市空气的主要污染物之一,其主要有害成分是CO、氮氧化物(NOx)等。
(1)NOx产生的原因之一是汽车发动机工作时引发N2和O2反应,其能量变化值如右图所示,
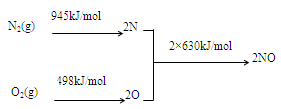
则:N2(g)+O2(g) 2NO(g)?△H= ?。 2NO(g)?△H= ?。
(2)汽车尾气中CO、NOx的有效消除成为环保领域的重要课题。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图一。
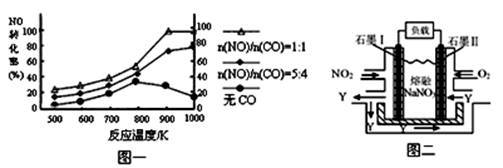
① NO与CO混存时,相互反应的化学方程式为?。
② 1000K,n(NO)/n(CO)=5:4时,NO的转化率为75%,则CO的转化率约为?。
③ 由于n(NO)/n(CO)在实际过程中是不断变化的,保证NO转化率较高的措施是将温度大约控制在?K之间。
(3)汽车尾气中NOx有望通过燃料电池实现转化。已经有人以 NO2、O2和熔融NaNO3制成了燃料电池,其原理如图二。
① 图中石墨Ⅱ为电池的?极。
② 在该电池使用过程中,石墨I电极上的产物是氧化物Y,其电极反应式为?。
(4)甲醇也可用于燃料电池。工业上采用反应CO2(g)+3H2(g)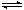 CH3OH(g)+H2O(g) ΔH<0合成甲醇。 CH3OH(g)+H2O(g) ΔH<0合成甲醇。
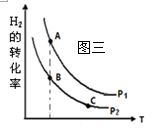
① 在恒容密闭反应器中,H2的平衡转化率与温度、压强的关
系如图三所示,则A、B、C三点处对应平衡常数(KA、KB、KC)的
大小关系为?。
② 某高温下,将6molCO2和8molH2充入2L密闭容器中发生
反应,达到平衡后测得c(CO2)=2.0mol·L-1,则该温度下反应的平
衡常数值为?。
参考答案:(16分,每空2分)
(1) +183 kJ·mol-1(2分,未写单位、未写“+”均扣1分)?
(2)①2CO+2NO=N2 +2CO2(2分,未配平扣1分); ②93%(按NO转化率算得结果为93.75%,但因受NO自身分解的影响,实际值会与计算值有差距,所以回答93.75%及相近的值都给分) ③800—900
(3) 正? NO2+NO3- -e- =N2O5
(4)①KA=KB>KC?②1/2
本题解析:(1)由图可知,氮气分子的共价键断裂需要吸收945kJ的能量,氧气分子的共价键断裂需要吸收498kJ的能量,而2N与2O结合成2个NO分子放出1260kJ的能量,所以△H=945+498-1260=+183kJ/mol;
(2)①NO与CO混存时,生成氮气和二氧化碳,化学方程式为2CO+2NO=N2 +2CO2;
②1000K,n(NO)/n(CO)=5:4时,NO的转化率为75%,设NO的物质的量是5mol,则CO的物质的量是4mol,消耗NO的物质的量是5mol×75%=3.75mol,则消耗CO 的物质的量是3.75mol,所以CO的转化率为3.75mol/4mol×100%=93.75%;
③由图一可知无论n(NO)/n(CO)为何值,800-900K时NO的转化率较高,超过900K,尽管有CO存在时的NO的转化率仍在升高,但无CO时NO的转化率却在下降,所以最适宜的温度是800-900K之间;
(3)氧气发生还原反应,所以通入氧气的极是电池的正极;石墨I通入的是二氧化氮气体,发生氧化反应,二氧化氮中N元素的化合价是+4价,N元素化合价升高只能升高到+5价,所以氧化物Y是N2O5,电极反应式为NO2+NO3- -e- =N2O5
(4)①A、B点的温度相同,所以平衡常数相同;C点温度高于B,温度升高,对正反应不利,平衡产生减小,所以三者的大小关系是KA=KB>KC;
②6molCO2和8molH2充入2L密闭容器中发生CO2(g)+3H2(g)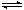 CH3OH(g)+H2O(g) 平衡后测得c(CO2)=2.0mol·L-1,则消耗二氧化碳的浓度是1mol/L,消耗氢气的浓度是3mol/L,生成的甲醇和水蒸气的浓度都是1mol/L,氢气的平衡浓度是mol/L,所以K=c(CH3OH)c(H2O)/c(CO2)c(H2)3=1/2 CH3OH(g)+H2O(g) 平衡后测得c(CO2)=2.0mol·L-1,则消耗二氧化碳的浓度是1mol/L,消耗氢气的浓度是3mol/L,生成的甲醇和水蒸气的浓度都是1mol/L,氢气的平衡浓度是mol/L,所以K=c(CH3OH)c(H2O)/c(CO2)c(H2)3=1/2
本题难度:一般
|  H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=  Na2SO4(aq)+H2O(l)?△H=-Q2kJ/mol
Na2SO4(aq)+H2O(l)?△H=-Q2kJ/mol