微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 据下图信息完成下列问题
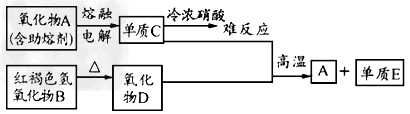
(1)A是________(填化学式,下同),E是________。
(2)元素C位于周期表中第____周期____族。
(3)写出下列反应的方程式:
A→C:__________________________。 C+D→A+E:__________________。
(4)已知电解氧化物A的过程中得到C单质1mol, 同时生成的气体在标准状况下的体积为
________L。
参考答案:(1)Al2O3;Fe
(2)三;ⅢA
(3)2Al2O3(熔融)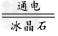 4Al+3O2↑;2Al+Fe2O3
4Al+3O2↑;2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
(4)16.8
本题解析:
本题难度:一般
2、简答题 中学化学中常见的物质有如图所示的转化关系(反应条件略去).X、Y、Z、W是单质,其余均为化合物,A、W、Z常温下呈气态,且A是一种大气污染物,B是一种常用的酸.
(1)写出下列物质的化学式:
Y______、A______、C______.
(2)D的电子式为______.
(3)我国生产B的工业中,常采用以下方式处理尾气A:
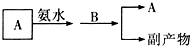
试从综合经济效益的角度分析,这样处理的目的是(答出其中两点即可):
a.______;b.______.
(4)反应①的化学方程式:______.
反应②的化学方程式:______.
反应④的离子方程式:______.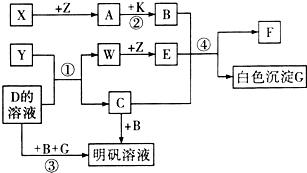
参考答案:A是一种大气污染物,可能为SO2或NO2,由题目可知,X、Z中只有Z为气体,则X应为S,Z为O2,A为SO2,B是一种常用的酸,应为H2SO4,题中SO2和K反应生成H2SO4,则K应为氧化性物质H2O2,H2SO4和C反应生成明矾,则C应为KAlO2,所以Y和D应为Al和KOH溶液的反应,则Y为Al,D为KOH,W为H2,E为H2O,生成物G为Al(OH)3,F为K2SO4,则
(1)由以上分析可知,Y为Al,A为SO2,C为KAlO2,故答案为:Al、SO2、KAlO2;
(2)D为KOH,为离子化合物,电子式为
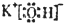
,故答案为:
;
(3)二氧化硫和氨水反应生成亚硫酸铵,进而与过氧化氢反应生成硫酸铵,可减少SO2对环境污染、使原料利用率得到提高、副产品可作化肥,
故答案为:a.减少SO2对环境污染;b.可以使原料利用率得到提高;c.副产品可作化肥,社会需求量大(任意填两种)
(4)反应①Al和KOH溶液的反应,反应的化学方程式为2Al+2KOH+2H2O=2KAlO2+3H2↑,反应②为H2O2和SO2的反应,反应的化学方程式为H2O2+SO2=H2SO4,反应④KAlO2与酸的反应,生成Al(OH)3沉淀,反应的离子方程式为AlO2-+H++H2O=Al(OH)3,
故答案为:2Al+2KOH+2H2O=2KAlO2+3H2↑;H2O2+SO2=H2SO4;AlO2-+H++H2O=Al(OH)3↓.
本题解析:
本题难度:一般
3、填空题 (8分)气体X对氢气的相对密度为22。X可由下列步骤合成(cat表示催化剂):

试根据题意回答下列问题:
(1)X的化学式为 ;X与CO2互为等电子体,所以可推测其分子结构呈 (型)。
(2)液态时的A能与金属钠反应生成F,熔融态的F能与X反应,其中生成一种固体G。G在受撞击时,生成两种单质,其中一种单质能与Li在常温下反应。试写出F+X→G的化学反应方程式 。
(3)D在较稀浓度(2mol/L)时能与Mg反应生成X。试写出化学反应方程式 ?。
(4)实验室制备少量的X,可将B通入K2SO3溶液中制得。请写出该反应的化学方程式 。
参考答案:

本题解析:略
本题难度:一般
4、填空题 (8分)由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系, 已知C为密度最小的气体。
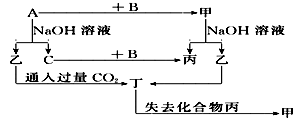
根据图示转化关系回答:
(1)若甲是电解质?写出下列物质的化学式:甲________,乙________,丁________?
写出乙与过量CO2反应的离子方程式_______________________?
(2)若甲是非电解质?写出下列物质的化学式:甲________,乙________,丁________?
参考答案:(1)Al2O3? NaAlO2? Al(OH)3
AlO2—+CO2+2H2O==Al(OH)3↓+HCO3—(2分)
(2)SiO2? Na2SiO3? H2SiO3 (或H4SiO4)
本题解析:略
本题难度:一般
5、简答题 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
(1)反应①的基本反应类型是______;
(2)C的化学式为______;
(3)写出物质E和B在加热条件下反应的化学方?程式______;
(4)将浅绿色溶液D转化为黄色溶液的方法是(用离子方程式表示)______.
(5)乙醇在A作催化剂的条件下可以被空气中的氧气催化氧化,试写出该反应的化学方程式:______.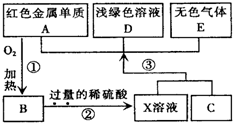
参考答案:由A为红色金属单质,则A为Cu,由反应①可知B为CuO,由反应②X为硫酸铜、硫酸混合溶液,由反应③X溶液+C→A+D+E,且D为浅绿色溶液(含有Fe2+),E为无色气体,故C为Fe,D为FeSO4,E为H2,
(1)反应①是2Cu+O2?点燃?.?2CuO,属于化合反应,故答案为:化合反应;
(2)由上述分析可知,C为Fe,故答案为:Fe;
(3)H2和CuO在加热条件下反应是Cu与H2O,反应方程式为:H2+CuO?△?.?Cu+H2O,故答案为:H2+CuO?△?.?Cu+H2O;
(4)利用强氧化剂将浅绿色FeSO4溶液转化为黄色Fe2(SO4)3溶液,如加入氯水等,反应离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(5)乙醇在Cu作催化剂的条件下可以被空气中的氧气催化氧化生成乙醛与水,该反应的化学方程式为:2CH3CH2OH+O2Cu
本题解析:
本题难度:一般