|
高考化学知识点归纳《金属的腐蚀与防护》高频考点特训(2017年练习版)(二)
2017-08-26 02:30:17
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
A.②①③④⑤⑥
B.⑤④③①②⑥
C.⑤④②①③⑥
D.⑤③②④①⑥
| 
参考答案:根据图知,②③④装置是原电池,在②④中,金属铁做负极,③中金属铁作正极,做负极的腐蚀速率快,并且两个电极金属活泼性相差越大,负极金属腐蚀速率越快,正极被保护,并且原电池原理引起的腐蚀>化学腐蚀,所以④>②>③,⑤⑥装置是电解池,⑤中金属铁为阳极,⑥中金属铁为阴极,阳极金属被腐蚀速率快,阴极被保护,即⑤>⑥,根据电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,并且原电池的正极金属腐蚀速率快于电解池的阴极金属腐蚀速率,即⑤④②①③⑥,故答案为:C.
本题解析:
本题难度:一般
2、选择题 关于下图所示各装置的叙述中 ,正确的是?(?) ,正确的是?(?)
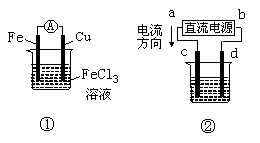
A.装置①是原电池,总反应是:Cu+2Fe3+ Cu2++2Fe2+ Cu2++2Fe2+
B.装置①中,铁做负极,该电极反应式为:Fe3++e- Fe2+ Fe2+
C.装置②为铁上镀铜装置c为纯铜电极
D.若用装置②精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
参考答案:C
本题解析:略
本题难度:一般
3、选择题
A.2H++2e-===H2
B.Fe2++2e-===Fe
C.2H2O+O2+4e-===4OH-
D.Fe3++e-===Fe2+
参考答案:C
本题解析:钢铁发生吸氧腐蚀,正极上是氧气得电子被还原的反应:2H2O+O2+4e-===
4OH-。
本题难度:简单
4、填空题 某兴趣小组采用如下方法制作氢氧燃料电池。

(1)如图A所示:a、b均为多孔石墨棒(多孔石墨棒,可吸附并储存生成的气体),其中a与直流电源正极相连,b与直流电源负极相连,电解质溶液为NaOH溶液,则a电极上发生的电极反应式为_________________,电解后溶液的pH____________(填“增大”、“减小”或“不变”)。
(2)然后如图B所示,移走直流电源,在a、b极间连接一个发光二极管,可以看到二极管发光。此时的电流方向是______________(填“a→b”或“b→a”),b极的电极反应式为______________________________ _。
(3)假设a极吸收22.4L(标准状况)气体,能量转化率为60%,则通过二极管的电子的物质的量为______________。
参考答案:(1)4OH--4e-=2H2O + O2↑(3分)?增大(2分)
(2)a→b?(2分) ?H2+2OH--2e-=2H2O(3分)? (3)2.4mol(2分)
本题解析:(1)a与直流电源正极相连,则a电极是阳极,所以溶液中的OH-放电生成氧气,电极反应式是4OH--4e-=2H2O + O2↑。惰性电极电解氢氧化钠溶液,相当于是电解水,所以氢氧化钠溶液的浓度增大,pH升高。
(2)由于a电极生成氧气,b电极生成氢气,所以此时是氢氧燃料电池,其中a是正极,b是负极,因此电流的方向是a→b;电解质是氢氧化钠溶液,所以负极电极反应式是?H2+2OH--2e-=2H2O。
(3)氧气的物质的量是1mol,在反应中得到4mol电子,由于能量的转化率是60%,因此通过二极管的电子的物质的量是4mol×60%=2.4mol。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。而在电解池中阳极失去,阴极得到电子,如果是惰性电极,则阳极是溶液中的阴离子失去电子,阴极是溶液中的阳离子得到电子,据此可以判断。
本题难度:一般
5、选择题 下列表述中,合理的是
A.将水加热,Kw增大,pH不变
B.把FeCl3的水溶液加热蒸干可得到FeCl3固体
C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液
D.用惰性电极电解足量的Cu(NO3)2溶液时,当有0.2 mole-转移时会析出6.4g铜
参考答案:D
本题解析:电离是吸热的,所以将水加热,水的离子积常数增大,但pH减小,A不正确。氯化铁水解产生氢氧化铁和氯化氢,水解吸热,加热促进水解,同时氯化氢挥发,促使水解平衡进一步向正反应方向移动,所以最终得到的是氢氧化铁,B不正确。高锰酸钾溶液具有氧化性,能腐蚀橡胶,应该用酸式滴定管量取,C不正确。D中铜的化合价由+2价降低到0价,得到2个电子,所以D正确,答案选D。
本题难度:简单
| 