| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《化学平衡常数》高频试题预测(2017年最新版)(九)
A.10min内甲容器中反应的平均速率v(A)=0.025mol/(L?min) B.由图可知:T1<T2,且该反应为放热反应 C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动 D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25% |

4、选择题 已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)
CH3OH(g)现在容积均为1L的a、b、c三个密闭容器中分别充入1mol?C0和2mol?H2的混合气体,控制温度,进行反应,测得相关数据的关系如图1和图2所示.下列说法中不正确的是( )
A.该反应的正反应的△H<0
B.反应进行到5min时,a容器中v(正)≠v(逆)
C.达到平衡时,a、b、c中CO的转化率为b>a>c
D.升温或减压,可将b中的平衡状态转变成c中的平衡状态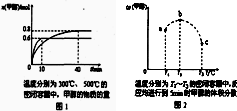
5、简答题 研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题.
(1)CO可用于合成甲醇.在压强为0.1Mpa条件下,在体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g)平衡时CO的转化率与温度,压强的关系如图: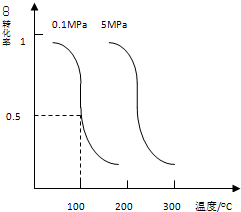
(i)该反应属于______反应:(填“吸热”或“放热”).
(ii)100℃时,该反应的平衡常数:K=______;(用a、b的代数式表示).若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是:______填序号)
a.该反应使用催化剂意义不大;
b.该反应发生将在很短时间内完成;
c.该反应达到平衡时至少有一种反应物百分含量很小;
d.该反应一定是放热反应;
(iii)在温度和容积不变的情况下,再向平衡体系中充入amolCO,2amolH2,达到平衡时CO转化率______(填“增大”,“不变”或“减小”,下同)平衡常数:______.
(iv)在某温度下,向一容积不变的密闭容器中充入2.5molCO,7.5molH2,反应生成CH3OH(g),达到平衡时,CO转化率为90%,此时容器内压强为开始时的压强______倍.
(2)某温度条件下,若将CO2(g)和H2(g)以体积比1:4混合,在适当压强和催化剂作用下可制得甲烷,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol
H2(g)+
| 1 2 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《复合材料》.. | |