微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72-+H2O  ?2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液, 溶液呈橙色。
?2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液, 溶液呈橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈_______色,平衡________。(填“向左移”或“向右移”,下同。)
(2)再加入过量稀H2SO4,则溶液呈_______色,平衡________。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡_______________,溶液颜色将__________。
参考答案:(1)黄色、向右移(2)橙红色、向左移(3)向右移变浅
本题解析:向上述溶液中加入NaOH溶液,中和H+平衡向正反应方向移动,黄色的CrO42-变多,溶液呈黄色。(1)中再加入过量稀H2SO4,平衡向逆反应方向移动,溶液呈橙红色。C(CrO42-)变小平衡向正反应方向移动,溶液颜色变浅,因为浓度变小了。
本题难度:一般
2、选择题 mA(g)+nB(g)?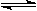 pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是(?)
pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是(?)
①体系的压强不再改变?②绝热体系的温度不再改变?③各组分的浓度不再改变
④各组分的质量分数不再改变?⑤反应速率vA:?vB:?vC:?vD = m:n:p:q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应?
A.③④⑤⑥
B.②③④⑥
C.①③④⑤
D.①③④⑥
参考答案:B
本题解析:①若该反应是反应前后气体体积相等的反应,则无论反应是否达到平衡,体系的压强都不会改变。因此不能作为判断反应是否达到平衡的标志。错误。?②任何反应发生的过程都伴随热量变化,若绝热体系的温度不再改变,则正向进行的程度与逆向进行的程度相同,反应达到平衡状态。因此可以作为判断反应达到偏高的标志。正确。③因为反应物、生成物的状态都是气态。若各组分的浓度不再改变,说明正反应速率与逆反应速率相同。反应达到平衡状态。正确。④各组分的质量分数不再改变?,说明任何物质的物质的量不变,浓度不变,正反应速率与逆反应速率都相同,反应达到平衡状态。正确。⑤在任何时刻反应混合物中各物质的反应速率vA:?vB:?vC:?vD =m:n:p:q。因此不能作为判断反应达到平衡状态的标志。错误。⑥单位时间内m mol A断键反应,就会有pmol的C键形成,同时p mol C也断键反应?;即C的物质的量不变。由于反应混合物都是气态,所以任何物质的物质的量不变,因此反应达到平衡状态。正确。故?达到平衡的标志是②③④⑥。选项是B。
本题难度:一般
3、简答题 氨是一种重要的化工原料,氨的合成和应用时当前的重要研究内容之一.
(1)一定条件下,在一个密闭的容器中充入气体:N22mol、H26mol,达到平衡后N2的转化率为50%,同时放热92.3kJ.
①该反应的热化学方程式为:______.
②升高温度,该反应的平衡常数K值______(填“增大”“减小”或“不变”).
③在一定条件下,在密闭容器中发生合成氨反应,N2、H2、NH3的起始浓度分别为c1、c2、c3(均不为0).当反应达到平衡时,它们的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L.下列说法中不正确的是______(填字母).
A.当H2与NH3生成速率为3:2时,反应一定达到平衡状态
B.H2与N2的转化率一定相等
C.c1一定等于0.14mol/L
D.c3的取值范围为0<c3<0.28mol/L
E.使用催化剂可以提高氨气的转化率
(2)利用反应8NH3+6NO2?7N2+12H2O可处理大气污染气体NO2.当转移1.2mol电子时,消耗的NO2在标况下的体积是______.
(3)最近科学家发明了不必使氨先裂化为氢就可以直接用于燃料电池的方法,其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2═2N2+6H2O,则通入氨气的一极应为______(填“正极”或“负极”),该电极反应式为______.
(4)工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放人电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×l0-31).已知电解后的溶液中c(Fe)为2.0×10-13mol/L,则溶液中c(Cr3+)为______mol/L.
参考答案:(1)一定条件下,在一个密闭的容器中充入气体:N22mol、H26mol,达到平衡后N2的转化率为50%,同时放热92.3kJ,说明反应1mol氮气放热92.3KJ,
①1mol氮气完全反应放热92.3kJ,反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.3kJ/mol,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.3kJ/mol;
②N2(g)+3H2(g)=2NH3(g)△H=-92.3kJ/mol,反应是放热反应,升温平衡逆向进行,平衡常数减小;
故答案为:减小;
③当反应达到平衡时,它们的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,
N2(g)+3H2(g)=2NH3(g)
0.1 0.3 0.08
0.140.42 0
00 0.28
A.当H2与NH3生成速率为3:2时,说明对氢气或氨气正逆反应速率相同,反应一定达到平衡状态,故A正确;
B.氮气和氢气平衡浓度之比为1;3,所以起始浓度一定按照1:3,所以H2与N2的转化率一定相等,故B正确;
C.如果c1一定等于0.14mol/L,那么反应应该是正向进行,而题中已知反应不一定是正方向进行,答案给的0.14是按照如果NH3的起始量为零的情况下正方向进行才会是0.14,因为转化量之比等于系数比,又由题知起始量不为零,故C错误;
D.按照极限法来算,如果正反应方向进行的,生成0.08mol,那么极限值NH3的起始量为零,如果逆反应方向进行那么生成0.1mol的N2和0.3mol的H2那么极限值的NH3起始量为0.28,又由题中条件告诉起始量不为零所以氨气的起始量应该介于0-0.28之间,c3的取值范围为0<c3<0.28mol/L,故D正确;
E.使用催化剂改变反应速率不改变化学平衡,所以不可以提高氨气的转化率,故E错误;
故答案为:CE;
(2)利用反应8NH3+6NO2?7N2+12H2O可处理大气污染气体NO2,转移24mol电子消耗二氧化氮6mol,当转移1.2mol电子时,消耗的NO2物质的量为0.3mol,标况下的体积为0.3mol×22.4L/mol=6.72L,
故答案为:6.72L;
(3)氨气为碱性气体,易与酸反应,所以电解质溶液应呈碱性,负极发生氧化反应,氨气被氧化生产氮气,电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:负极;2NH3-6e-+6OH-=N2+6H2O;
(4)电解后溶液中c(Fe3+)=2.0×10-13mol/L,则溶液中c3(OH-)=4×10-382×10-13mol/L=2×10-25mol/L,故溶液中c(Cr3+)=6×10-312×10-25mol/L=3×10-6mol/L,
故答案为:3×10-6.
本题解析:
本题难度:简单
4、选择题 反应 aA(气)+ bB气) cC(气)有如下性质:
cC(气)有如下性质:
V正=K1[A]a·[B]b、V逆=K2[C]c、K1,K2温度不变时分别为一常数,在其他条件不变时,当压强增大一倍,则V正应为原来的
A.a倍
B.b倍
C.2a倍
D.2a+b倍
参考答案:D
本题解析:其他条件不变时,当压强增大一倍,各物质的浓度亦增大一倍。则V正=K1[2A]a·[2B]b=K1·[A]a·[B]b·2a+b,即V正变为原来的2a+b倍。
本题难度:一般
5、选择题 在恒温、恒压下,a mol A和b molB在一个容积可变的容器中发生反应:A(g) +2B(g) 2C(g),一段时间后达到平衡,生成n mol C。下列说法正确的
2C(g),一段时间后达到平衡,生成n mol C。下列说法正确的
A.物质A、B的转化率之比为l:2
B.起始时刻和达到平衡后容器中的压强之比为(a+b):(a+b-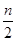 )
)
C.当v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体,平衡向逆反应方向移动
参考答案:D
本题解析:A.根据反应方程式中各物质的关系可知:若平衡时得到C物质nmol,则消耗A物质n/2mol,A的转化率为n/2mol÷amol,消耗 B物质nmol,B的转化率为nmol÷bmol. 物质A、B的转化率之比为lb:2a.错误。B.由于反应条件为恒压,所以反应前后压强相等。错误。C.当v正(A)=v逆(A)时,反应一定达到平衡状态。但v逆(B)=2v逆(A).所以v正(A)=v逆(B)时,反应一定未达到平衡状态 。错误。D.充入惰性气体,由于恒压,容器的容积扩大,反应混合物的浓度都减小,反应物的浓度减小的多,所以平衡向逆反应方向移动。正确。
本题难度:一般