微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,lmol TaI4和n mol S2在2L的密闭容器中发生反应TaI4(g)+S2(g)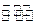 2TaS2(s)+2I2(g),t min后达到平衡,此时生成2a mol I2。下列说法正确的是?(?)
2TaS2(s)+2I2(g),t min后达到平衡,此时生成2a mol I2。下列说法正确的是?(?)
A.用TaI4表示此反应的反应速率是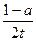 mol/(L·min)
mol/(L·min)
B.向平衡后的体系中加入lmol TaS2,平衡向逆反应方向移动
C.给平衡后的体系升温,化学平衡一定移动
D.向平衡后的体系中充入lmol TaI4,v(正)增大,v(逆)减小,平衡正向移动
参考答案:C
本题解析:略
本题难度:简单
2、选择题 有关化学平衡常数(K)的说法中不正确的是(?)
A.K值越大,正反应进行的程度越大
B.一般地说,K>105时,该反应进行得就基本完全了
C.压强越大,K值越大
D.K与反应物或生成物的浓度变化无关
参考答案:C
本题解析: K值越大,正反应进行的程度越大,故A正确;一般地说,K>105时,该反应进行得就基本完全了,故B正确;对于如A(g)+B(g)  C(g)+D(g)的反应,压强对其没有影响,故压强越大,K值不一定越大,故C错误,为本题的正确答案;K与反应物或生成物的浓度变化无关,对于一个给定的反应,K的值只与温度有关,故D正确。
C(g)+D(g)的反应,压强对其没有影响,故压强越大,K值不一定越大,故C错误,为本题的正确答案;K与反应物或生成物的浓度变化无关,对于一个给定的反应,K的值只与温度有关,故D正确。
点评:本题考查了化学平衡常数,该考点是高考考查的重点和难度,本题要掌握的是平衡常数只与温度有关,K值越大,正反应进行的程度越大 ,本题难度适中。
本题难度:一般
3、填空题 某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
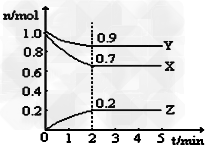
(1)该反应的化学方程式为_____________。
(2)反应开始至2min,以气体Z表示的平均反应速率为___________。
(3)2min反应达平衡,容器内混合气体的平均相对分子质量比起始时____________(填“大”,“小”或“相等”下同),混合气体密度比起始时____________。
(4)将a?mol?X与b?mol?Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n?(X)?=?n?(Y)?=?n?(Z),则原混合气体中a?:?b?=__________。
参考答案:(1)3X+Y 2Z?
2Z?
(2)0.02?mol/(L·min)或3.3×10-4?mol/(L·s)
(3)大;相等
(4)5:3
本题解析:
本题难度:一般
4、填空题 在一个固定容积的密闭容器中,在一定温度下发生下列反应:
A(g)+B(g)→2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为
p mol/L,且C的体积分数为ω。在相同条件下:
(1)若在相同容器中加入2molA和4molB,达平衡后,C的物质的量浓度为_______mol/L;
(2)若在相同容器中加入0.5molC,要求平衡后C的浓度为0.5p mol/L,且C的体积分数为ω,则还应在容器中加入A______mol,B______mol;?
(3)若在相同容 器中加入a mol A、b mol B、c mol C,并要求平衡后C的浓度为p mol/L,C的体积分数仍为ω,则a、b、c应符合的关系是__________________________(其中一个只含a和b,另一个只含a和c)。?
器中加入a mol A、b mol B、c mol C,并要求平衡后C的浓度为p mol/L,C的体积分数仍为ω,则a、b、c应符合的关系是__________________________(其中一个只含a和b,另一个只含a和c)。?
参考答案:(1) 2p(2分)?
(2) 0.25(2分);? 0.75 (2分)?
(3) b-a=1, a+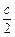 ="1" (全对得3分,部分对得1分)
="1" (全对得3分,部分对得1分)
本题解析:略
本题难度:简单
5、选择题 化学平衡状态I、II、III的相关数据如下表:
编号
| 化学方程式
| 平衡常数
| 温度
|
979K
| 1173K
|
I
| Fe(s)+CO2(g) 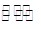 2 FeO(s)+CO(g) 2 FeO(s)+CO(g)
| K1
| 1.47
| 2.15
|
II
| CO(g)+H2O(g) 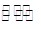 CO2(g)+H2(g) CO2(g)+H2(g)
| K2
| 1.62
| b
|
III
| Fe(s)+H2O(g)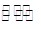 FeO(s)+H2(g) FeO(s)+H2(g)
| K3
| a
| 1.68
|
根据以上信息判断,下列结论错误的是
A.a>b?B.增大压强,平衡状态II不移动
C.升高温度平衡状态III向正反应方向移动?D.反应II、III均为放热反应
参考答案:C
本题解析:根据化学平衡常数表达式的书写原则知,K1=[CO]/[CO2], K2=[CO2][H2]/[CO][H2O], K3=[H2]/[H2O],则有相同温度下,K3=K1?K2,979K平衡常数a=1.47×1.62=2.38,1173K平衡常数b=1.68/2.15=0.78。A、根据上述分析知a>b,正确;B、反应Ⅱ是反应前后气体物质的量不变的反应,增大压强平衡不动,正确;C、根据上述分析知,反应Ⅲ平衡常数随温度升高减小,平衡逆向进行,错误;D、反应Ⅱ、Ⅲ的平衡常 数随温度升高减小,说明正反应为放热反应,正确。
本题难度:简单