微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于某些离子的检验及结论一定正确的是
A.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
B.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
C.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
D.加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+
参考答案:B
本题解析:A、氯化钡能与硫酸根离子或银离子结合生成不溶于水也不溶于酸的沉淀,故A错误;B、湿润红色石蕊试纸遇碱性物质变蓝,即产生的气体是氨气,因此一定含有铵根离子,故B正确;C、盐酸能与含碳酸根或碳酸氢根离子的物质反应生成二氧化碳,故C不正确;D、碳酸钠能与含可溶性钙离子或钡离子的物质结合生成沉淀,故D错误,答案选B。
本题难度:一般
2、选择题 下列说法不正确的是
A.无论乙烯与丙烯酸以何种比例混合,只要二者总物质的量是个定值,完全燃烧时所
消耗的氧气也一定是个定值
B.鉴别甲苯、苯乙烯、苯酚、丙烯酸溶液可选用KMnO4溶液、溴水
C.可以利用燃烧法来区别聚乙烯塑料和聚氯乙烯塑料、毛和棉
D.装溴水、高锰酸钾溶液的试剂瓶不能用橡胶塞,因为橡胶分子中含有碳碳双键
参考答案:B
本题解析:选项A,1mol C2H4完全燃烧消耗3mol O2,1mol CH2=CH-COOH完全燃烧也消耗3mol O2,所以二者总物质的量不变时,消耗的O2也不变。选项B,利用溴水能鉴别出甲苯(萃取原理)、苯酚(产生白色混浊),但无法鉴别出苯乙烯和丙烯酸(二者均能使溴水褪色),也不能用KMnO4溶解鉴别出苯乙烯和丙烯酸(二者均能使KMnO4溶液褪色)。选项C,燃烧聚乙烯时闻不到明显味道,燃烧聚氯乙烯时能闻到刺激性味道(释放出HCl),燃烧毛时能闻到烧焦羽毛味道,燃烧棉时能闻到烧纸味道,故可根据燃烧产生的味道不同鉴别。选项D,因橡胶中含有碳碳双键,碳碳双键能与Br2发生加成反应、能被KMnO4溶液氧化,所以不能用橡胶塞的试剂瓶来装溴水和KMnO4溶液
本题难度:一般
3、选择题 把少量的溴水注入KI溶液中,经充分反应后,加入CCl4用力振荡,静置后可观察到
A.液体分成两层,下层呈紫色
B.液体分成两层,上层呈紫色
C.混合液不分层,且无色透明
D.混合液不分层,且呈褐色
参考答案:A
本题解析:溴的非金属性强于碘元素的,所以把少量的溴水注入KI溶液中,生成单质碘。碘易溶在有机溶剂中,且四氯化碳的密度大于水的,所以加入CCl4用力振荡,静置后可观察到实验现象是液体分成两层,下层呈紫色,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题,试题侧重基础,注重对学生规范实验设计能力的培养和训练,有利于培养学生的逻辑推理能力和发散思维能力,提高学生的应试能力。
本题难度:一般
4、填空题 (6分)对一份稀溶液作初步分析发现,溶液无色、澄清,其中可能含有SO42—、Na+、CO32— 、H+、Cl—等离子中的若干种。然后又做了如下实验,以确认这些离子是否大量存在。
(1)用pH试纸测溶液的pH值,试纸显红色;
(2)取 2mL上述溶液,加入足量硝酸钡溶液,结果生成了不溶于稀硝酸的白色沉淀;
2mL上述溶液,加入足量硝酸钡溶液,结果生成了不溶于稀硝酸的白色沉淀;
(3)取(2)中的上层清液,加入硝酸银溶液,结果又生成了不溶于稀硝酸的白色沉淀。
问:上述实验可以确定溶液中一定含有?离子,一定没有?离子。
设计实验方案检验不能确定的其他离子。
_____ ____________________________________________________________________
_________________________________________________________________________
参考答案:一定含有H+、SO42-、Cl-离子,一定没有CO32-离子。
用洁净的铂丝蘸取原溶液进行焰色反应实验,如果看到火焰呈黄色,则原溶液中有Na+。
(每空2分)
本题解析:略
本题难度:一般
5、填空题 某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
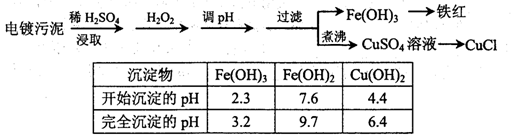
(1)酸浸后加入H2O2的目的是?。调pH步骤中加入的试剂最好是?(填化学式)。实验室进行过滤操作所用到的玻璃仪器有?。
(2)煮沸CuSO4溶液的原因是?。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式?。
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准。称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液24.60mL。有关的化学反应为:
Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。通过计算说明该CuCl样品?(填“符合”或“不符合”)国家标准。
(4)25℃时,KSP [Fe(OH)3]= 4.0×10-38。Fe3+发生水解反应Fe3++3H2O Fe(OH)3+3H+,该反应的平衡常数为?。
Fe(OH)3+3H+,该反应的平衡常数为?。
参考答案:(14分)(1)将Fe2+氧化成Fe3+,便于调整pH值与Cu2+分离(2分);
CuO或Cu(OH)2、CuCO3等(2分);漏斗、烧杯、玻璃棒(2分)
(2)除净溶液中的H2O2,避免影响下一步CuCl的生成(2分)
2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4(2分)
(3)符合(2分)?(4)2.5×10-5(2分)
本题解析:(1)电镀污泥中含有铜、铁等金属化合物,酸浸后主要是溶解铜、铁等金属化合物。双氧水有强氧化性,能氧化还原性的物质,Fe2+具有还原性,酸浸后加入H2O2,Fe2+能被双氧水氧化为Fe3+,便于调整pH值与Cu2+分离;在调整pH步骤中加入的试剂是用来除去溶液中的酸,且不能引进新的杂质,所以要加入的试剂可以是CuO或Cu(OH)2或CuCO3;根据表中数据可知,当溶液的pH值4.4时,铜离子开始出现沉淀,当溶液的pH值为3.2时,三价铁离子沉淀完全,铜离子未产生沉淀,所以要使三价铁离子和铜离子分离,溶液的pH应该是3.2≤pH<4.4.生成的氢氧化铁沉淀可以通过过滤实现分离,过滤操用到的仪器有铁架台、漏斗、烧杯、玻璃棒等;其中属于玻璃仪器有漏斗、烧杯、玻璃棒。
(2)反应中过氧化氢是过量的,过氧化氢均有氧化性,如果不除去会影响CuCl的生成。双氧水受热易分解,所以煮沸CuSO4溶液的原因是除净溶液中的H2O2,避免影响下一步CuCl的生成;因为CuSO4中+2价的铜能把Na2SO3中+4价的硫氧化成+6价的硫,而+2价的铜被还原生成+1价的铜,进而生成CuCl沉淀,所以该反应的化学方程式为2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4。
(3)设样品中CuCl的质量为x,有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+,则由化学反应方程式可知:CuCl~~~Fe2+~~~Ce4+?
1?1
n(CuCl)?24.60×10-3L×0.1000?mol/L
解得?n(CuCl)=24.60×10-3L×0.1000?mol/L=2.46×10-3mol
所以该样品CuCl的质量为2.46×10-3mol×99.5g/mol=0.2448g
所以样品中CuCl的质量分数=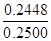 ×100%=97.91%>96.50%,所以该样品中CuCl的质量分数符合标准。
×100%=97.91%>96.50%,所以该样品中CuCl的质量分数符合标准。
(4)KSP [Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38。c(H+)=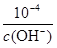 ,因此反应Fe3++3 H2O
,因此反应Fe3++3 H2O Fe(OH)3+3H+的平衡常数K=
Fe(OH)3+3H+的平衡常数K=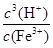 =
=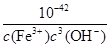 =2.5×10-5。
=2.5×10-5。
本题难度:困难