微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应2X-+Z2====2Z-+X2、2W-+X22X-====+W2能从左向右进行,则反应:W2+2Z-====Z2+2W-进行的方向是(? )
A.从左向右
B.从右向左
C.不能进行
D.无法判断
参考答案:B
本题解析:由题意可知,氧化性为:Z2>X2>W2,根据氧化性强的物质生成氧化性弱的物质,Z2可制备W2。
本题难度:简单
2、计算题 已知稀硝酸与铜反应时,NO3- 一般被还原为NO;浓硝酸与铜反应时,NO3- 一般被还原为NO2。现将25.6gCu投入到50mL12mol/L的浓硝酸中,充分反应后,收集到4.48L(标况)NO和NO2的混合气体。
(1)写出铜分别与浓硝酸和稀硝酸反应的化学方程式:______________________________________________________________;
_______________________________________________________________。
(2)被还原的硝酸的物质的量为:____________
(3)25.6gCu与50mL12mol/L的浓硝酸反应后,剩余物为:____________,其物质的量为:____________。
参考答案:(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3 Cu(NO3)2+2NO↑+4H2O?
(2)0.2mol (3)铜; 0.2mol
本题解析:(1)硝酸具有强氧化性,和金属铜反应的化学方程式分别是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3 Cu(NO3)2+2NO↑+4H2O。
(2)硝酸被还原生成NO或NO2,所以被还原的硝酸的物质的量就是生成的混合气的物质的量,即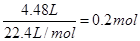 。
。
(3)根据(2)可知,没有被还原的硝酸的物质的量是
0.05L×12mol/L-0.2mol=0.4mol
25.6g铜的物质的量是25.6g÷64g/mol=0.4mol
如果铜完全反应则应该生成0.4mol硝酸铜
则没有被还原的硝酸的物质的量就是0.8mol>0.4mol
这说明反应中硝酸是不足的,铜过量
应该生成硝酸铜的物质的量是0.4mol÷2-0.2mol=0.2mol
所以过量的铜的物质的量是0.4mol-0.2mol=0.2mol
点评:该题是属于中等难度的计算题,本题的关键是学会利用好各种守恒法解题,化学计算中常用的守恒法包括质量守恒定律、原子守恒、电子的得失守恒以及电荷守恒等,需要学生在平时的训练注意总结、归纳和积累。
本题难度:一般
3、填空题 某厂废水中含5.00×10-3mol·L-1的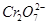 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料 (
( 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
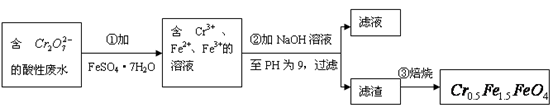
(1)第①步反应的离子方程式是?
(2)第②步中用PH试纸测定溶液PH的操作是:
?
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有?
(4)欲使1L该废水中的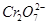 完全转化为
完全转化为 。理论上需要加入?
。理论上需要加入?
GFeSO4·7H2O。
参考答案:
(1)Cr2O72- + 6Fe2+ + 14H+ 2Cr3+ + 6Fe3+?+ 7H2O
2Cr3+ + 6Fe3+?+ 7H2O
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照
(3)Fe(OH)3、Fe(OH)2
(4)13.9
本题解析:(1)第①步是Cr2O72-与Fe2+发生氧化还原反应,方程式为:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(2)测定溶液的pH的方法是:用玻璃棒蘸取待测溶液滴在pH试纸的中心位置,然后对照标准比色卡,读出对应颜色的数据;
(3)从最终所得磁性材料的化学式可知,滤渣中主要有Cr(OH)3、Fe(OH)2、Fe(OH)3;
(4)1L废水中的n(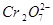 )=5.00×10-3mol,根据关系式:
)=5.00×10-3mol,根据关系式: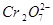 ~4Cr0.5Fe1.5FeO4~
~4Cr0.5Fe1.5FeO4~
10FeSO4·7H2O,所以理论上n(FeSO4·7H2O)=0.05mol,m(FeSO4·7H2O)= 0.05mol
本题难度:一般
4、选择题 KOH是我国古代纺织业常用的洗涤剂,古代制取KOH的流程如图,在上述流程中没有涉及的化学反应类型是
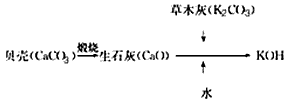
[? ]
A.化合反应
B.分解反应
C.复分解反应
D.置换反应
参考答案:D
本题解析:
本题难度:简单
5、选择题 赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应: Cu2S?+?2Cu2O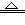 6Cu?+?SO2↑。对于该反应的下列说法正确的是?
6Cu?+?SO2↑。对于该反应的下列说法正确的是?
[? ]
A.该反应中的氧化剂只有Cu2O?
B.Cu2O在反应中既是氧化剂又是还原剂 ?
C.Cu既是氧化产物又是还原产物?
D.氧化产物与还原产物的物质的量之比为1:6
参考答案:D
本题解析:
本题难度:一般