微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 已知稀硝酸与铜反应时,NO3- 一般被还原为NO;浓硝酸与铜反应时,NO3- 一般被还原为NO2。现将25.6gCu投入到50mL12mol/L的浓硝酸中,充分反应后,收集到4.48L(标况)NO和NO2的混合气体。
(1)写出铜分别与浓硝酸和稀硝酸反应的化学方程式:______________________________________________________________;
_______________________________________________________________。
(2)被还原的硝酸的物质的量为:____________
(3)25.6gCu与50mL12mol/L的浓硝酸反应后,剩余物为:____________,其物质的量为:____________。
参考答案:(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3 Cu(NO3)2+2NO↑+4H2O?
(2)0.2mol (3)铜; 0.2mol
本题解析:(1)硝酸具有强氧化性,和金属铜反应的化学方程式分别是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3 Cu(NO3)2+2NO↑+4H2O。
(2)硝酸被还原生成NO或NO2,所以被还原的硝酸的物质的量就是生成的混合气的物质的量,即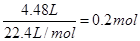 。
。
(3)根据(2)可知,没有被还原的硝酸的物质的量是
0.05L×12mol/L-0.2mol=0.4mol
25.6g铜的物质的量是25.6g÷64g/mol=0.4mol
如果铜完全反应则应该生成0.4mol硝酸铜
则没有被还原的硝酸的物质的量就是0.8mol>0.4mol
这说明反应中硝酸是不足的,铜过量
应该生成硝酸铜的物质的量是0.4mol÷2-0.2mol=0.2mol
所以过量的铜的物质的量是0.4mol-0.2mol=0.2mol
点评:该题是属于中等难度的计算题,本题的关键是学会利用好各种守恒法解题,化学计算中常用的守恒法包括质量守恒定律、原子守恒、电子的得失守恒以及电荷守恒等,需要学生在平时的训练注意总结、归纳和积累。
本题难度:一般
2、选择题 氧化还原反应中实际上包含氧化和还原两个过程。某氧化还原反应的一个还原过程的反应式为:S2O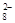 +2e-
+2e- 2SO
2SO ,该反应中另一重要反应物可能是KMnO4、Na2CO3、MnSO4、KNO3四种物质中的一种。下列有关说法正确的是( )
,该反应中另一重要反应物可能是KMnO4、Na2CO3、MnSO4、KNO3四种物质中的一种。下列有关说法正确的是( )
A.S2O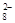 中S显+7价,说明S的最外层有7个电子
中S显+7价,说明S的最外层有7个电子
B.该反应中另一重要反应物为KMnO4
C.该反应的氧化过程可表示为:Mn2+-5e-+4H2O MnO
MnO +8H+
+8H+
D.若有5mol S2O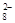 参与反应,溶液中会生成8 mol H+
参与反应,溶液中会生成8 mol H+
参考答案:C
本题解析:考查氧化还原反应的相关计算
A、S2O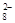 中S显+7价,但S的最外层有只有6个电子,化合价只是元素呈现的一种性质,与元素原子的最外层电子数没有必然的联系
中S显+7价,但S的最外层有只有6个电子,化合价只是元素呈现的一种性质,与元素原子的最外层电子数没有必然的联系
B、S2O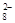 得电子,发生氧化反应,必然有另一物质失电子,它的元素化合价将升高,观察题目所给四种物质可看出,只有MnSO4中锰元素外于低价,可以被氧化,故该反应中另一重要反应物为MnSO4
得电子,发生氧化反应,必然有另一物质失电子,它的元素化合价将升高,观察题目所给四种物质可看出,只有MnSO4中锰元素外于低价,可以被氧化,故该反应中另一重要反应物为MnSO4
C、正确(可先写出总的氧化还原反应方程式,减去题目所给还原反应即可得到)
D、根据电子的得失守恒,若有5mol S2O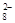 参与反应,转移的电子数为10 mol,由氧化过程可知,溶液中会生成16 mol H+
参与反应,转移的电子数为10 mol,由氧化过程可知,溶液中会生成16 mol H+
故答案为C
本题难度:一般
3、填空题 据新闻媒体报道,误食亚硝酸钠已造成多起人畜中毒事件,因为它外观类似食盐又有像食盐一样的咸味。亚硝酸钠能引起人体中毒。已知亚硝酸钠能发生如下反应:
NaNO2+HI——NO↑+I2+NaI+H2O
(1)上述反应中,氧化剂是__________,若有0.05 mol还原剂被氧化,则被还原的氧化剂是____________mol。
(2)根据上述反应,可以用试纸和一些生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。可供选用的物质有:①自来水,②碘化钾淀粉试纸,③淀粉,④白糖,⑤食醋,⑥白酒。进行实验时,必须使用的物质有(填编号)____________。
(3)某厂废切削液中有2%—5%NaNO2,直接排放会造成环境污染,在下列试剂中:①NaCl,②NH4Cl,③H2O2④浓H2SO4,能使NaNO2转化为不引起二次污染的N2的是(填编号)_________,化学方程式为___________________________________________。
参考答案:(1)NaNO2? 0.05?(2)②⑤?(3)②? NH4Cl+NaNO2====N2↑+NaCl+2H2O
本题解析:(1)根据反应方程式中价态变化可知NaNO2中N的化合价降低,被还原,NaNO2作氧化剂,
又因为2NaNO2+4HI====2NO↑+I2+2NaI+2H2O
所以参加反应的HI有一半被氧化,被还原的氧化剂是0.05 mol。
(2)根据题意可知鉴别NaNO2与NaCl只能利用(1)中反应,在酸性条件下,NaNO2可把I-氧化成I2,故选用②⑤。
(3)②,NH4Cl+NaNO2====N2↑+NaCl+2H2O
本题难度:简单
4、选择题 下列变化过程属于还原反应的是
[? ]
A.H2→H2O
B.CuO→Cu
C.Mg→Mg2+
D.Fe2+→Fe3+
参考答案:B
本题解析:
试题分析:
选项A,H2→H2O,H元素化合价升高,发生氧化反应。
选项B,CuO→Cu,Cu元素化合价降低,发生还原反应。
选项C,Mg→Mg2+,Mg元素化合价升高,发生氧化反应。
选项D,Fe2+→Fe3+,Fe元素化合价升高,发生氧化反应。
故选:B
本题难度:简单
5、选择题 锌和稀硝酸反应时,消耗的锌和参加反应硝酸的物质的量之比是2∶5,这时硝酸的还原产物是(?)
A.NO
B.N2O
C.N2O3
D.NO2
参考答案:B
本题解析:注意利用原子守恒和得失电子守恒结合直接进行判断,也可以将方程式配平后判断。还原产物可能为NO,也可能为NH4NO3。
本题难度:简单