微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 固体粉末X中可能含有Fe、FeO、CuO、MnO2、KCl和K2CO3中的若干种.
为确定该固体粉末的成分,某同学依次进行了以下实验:
①将X加入足量水中,得到不溶物Y和溶液Z;
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物;
③向Z溶液中滴加AgNO3溶液,生成白色沉淀;
④用玻璃棒蘸取溶液Z于广范pH试纸上,试纸呈蓝色.
分析以上实验现象,下列结论正确的是( )
A.X中一定不存在FeO
B.不溶物Y中一定含有Fe和CuO
C.Z溶液中一定含有KCl、K2CO3
D.Y中不一定存在MnO2
参考答案:①将X加入足量水中,得到不溶物Y和溶液Z,Y可能为Fe、FeO、CuO、MnO2中的物质,Z可能为KCl和K2CO3中的物质;
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物,黄绿色气体为氯气,红色不溶物为铜,可说明Y中至少含有CuO、MnO2,并应含有Fe;
③向Z溶液中滴加AgNO3溶液,生成白色沉淀,可能为氯化银或碳酸银沉淀;
④用玻璃棒蘸取溶液Z于广范pH试纸上,试纸呈蓝色,说明溶液呈碱性,应含有K2CO3,可能含有KCl,
由以上分析可知X中应含有CuO、MnO2、K2CO3以及Fe,但不能确定是否含有FeO、KCl,
故选B.
本题解析:
本题难度:一般
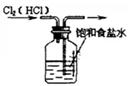
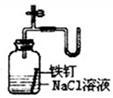
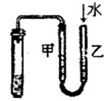
2、选择题 如图所示的实验中,能达到实验目的的是
| 
| 
| 
|
①除去Cl2中的HCl杂质
| ②用铜和稀硝酸制取少量NO
| ③证明铁生锈时空气参与反应
| ④检验装置气密性
|
?
A.①②③④? B.③④? C.②③④? D.①④
参考答案:B
本题解析:氯化氢极易溶于水,则除去Cl2中的HCl杂质可以选择饱和食盐水,但应该是长口进,短口出,①不正确;NO极易被氧化生成NO2,所以不能用排空气法收集,②不正确;实验③中铁生锈时如果空气参与反应,则U形瓶中但液面会发生变化,据此可以判断,③正确;根据检验装置气密性的方法可知,选项④正确,答案选B。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般
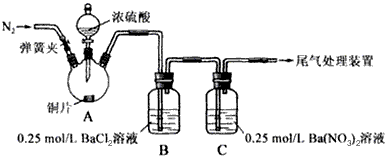
3、实验题 甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
|
实验操作和现象
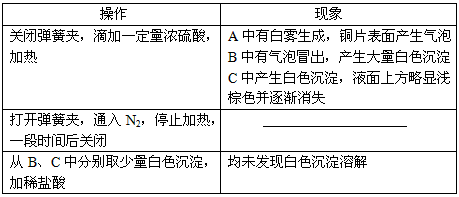
⑴A中反应的化学方程式是_______________。
⑵C中白色沉淀是__________,该沉淀的生成表明SO2具有____________性。
⑶C中液面上方生成浅棕色气体的化学方程式是____________________________。
⑷分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是______________;乙在A、B间增加洗气瓶D,D中盛放的试剂是______________。
②进行实验,B中现象
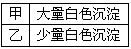
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:______________。
⑸合并⑷中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是____________________________。
参考答案:⑴Cu+2H2SO4 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
⑵H2SO4;还原
⑶2NO+O2==2NO2
⑷①通N2一段时间,排除装置中的空气;饱和NaHSO3溶液;②甲:SO42-+Ba2+==BaSO4↓,
乙:2Ba2++2SO2+O2+2H2O==2BaSO4↓+4H+,白雾的量远多于装置中O2的量
⑸SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀
本题解析:
本题难度:困难
4、填空题 (15分)蓝铜矿主要含2CuCO3·Cu(OH)2,还含有少量Fe、Si的化合物,工业上以蓝铜矿为原料制备Cu及CaCO3,方法有多种。
(1)蓝铜矿与焦炭加热可以生成铜、二氧化碳和水,写出该反应的化学方程式。______________________________________________________________。
具体方法步骤如下:?
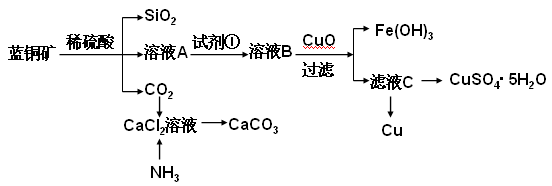
请回答下列问题:
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:检验溶液A中含有Fe2+的最佳试剂为?(填代号),实验步骤中试剂①为?(填代号)。
a.KMnO4? b.(NH4) 2S? c.H2O2? d.KSCN
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发,冷却结晶、过滤等操作,加热蒸发至? ___________________时停止加热。玻璃棒在整个操作中的作用是? ________________?。
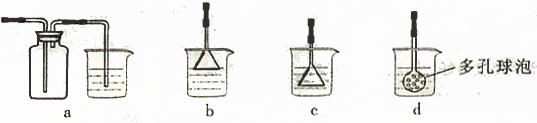
(4)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)?(填化学式)。若实验过程中有氨气逸出、应选用下列?装置吸收尾气(填代号)。
(5)从溶液C中获得Cu的方法有?(写出两种不同方法)。
(6)用惰性电极电解硫酸铜溶液一段时间后,加入2molCu(OH)2固体使硫酸铜溶液复原(复原是指溶液溶质成分及浓度与原来完全相同),则此电解过程中共转移电子?mol。
参考答案:(1)2[2CuCO3·Cu(OH)2]+3C 6Cu+7CO2↑+2 H2O (3分)?
6Cu+7CO2↑+2 H2O (3分)?
(2)a? c?(2分,各1分)?(3)有少量晶膜出现时(有少量晶体出现也可)(2分)引流、搅拌(2分)?(4)NH3(1分)? b?(1分)?(5)加入活泼金属Fe(或者写具体能制出Cu的其它金属也可)、用惰性电极电解硫酸铜溶液。?(2分)?(6) 8?(2分)
本题解析:略
本题难度:一般
5、简答题 在潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可用于制取氧气.
(1)A是用CaCO3制取CO2的装置.写出A中发生反应的化学方程式:______.
(2)按要求填写表中空格:
| 仪器编号 | 盛放的试剂 | 加入该试剂的目的
B
饱和NaHCO3溶液
?
C
?
?
D
?
吸收未反应的CO2气体
|
(3)试管F中收集满气体后,下一步实验操作是______,证明收集到的气体是氧气的方法是______.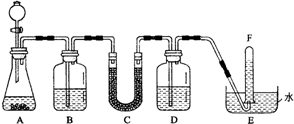
参考答案:(1)依据装置图分析,制备二氧化碳气体是利用石灰石和盐酸反应生成二氧化碳气体,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑,
故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)生成的二氧化碳气体中含有杂质气体氯化氢、水蒸气;利用碳酸氢钠溶液可以除去氯化氢,通过C中的过氧化钠反应生成氧气,再通过氢氧化钠溶液吸收多余的二氧化碳,最后收集到纯净的氧气,
故答案为:仪器编号盛放的试剂加入该试剂的目的B?除去CO2气体中混入的HClC过氧化钠与CO2及水气反应,产生O2DNaOH溶液?(3)为防止倒吸需要先把导气管从水槽中拿出,用姆指堵住试管口,取出试管,带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气,
故答案为:把E中的导管移出水面,关闭分液漏斗活塞,用姆指堵住试管口,取出试管;立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气本是氧气.
本题解析:
本题难度:一般