微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,可逆反应A(s)+2B(g)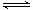 2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。
2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。
下列说法正确的是
A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
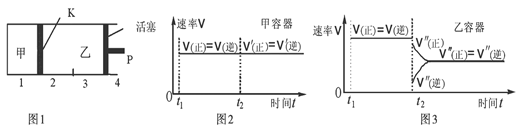
B.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持活塞位置不变,改变温度,达到新的平衡后,甲、乙中B的体积分数均增大
参考答案:B
本题解析:A错,t1时两容器内均达到平衡状态时两容器内各组分的浓度完全相同,当在甲中再加入1 mol A和2 mol B后,相当于在将乙的容器压缩为原来的一半,则平衡将向逆反应方向移动,达到新的平衡后,甲中C的浓度小于乙中C的浓度的2倍;B正确;C错,保持温度不变,移动活塞P,使乙的容积和甲相等,在这个瞬间,乙中C的体积分数是甲中C的体积分数的2倍,随后平衡将向逆反应方向移动,达到新的平衡时,乙中C的体积分数小于甲中C的体积分数的2倍;D错,改变温度不清楚是升高温度还是降低温度;无法判断;
本题难度:一般
2、简答题 (1)在一定条件下,容积为100L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0
将1.0molCH4和2.0molH2O(g)通入该密闭容器l0min时有0.1molCO生成,则10min内该反应的平均速率v(H2)______.
(2)在压强为0.1MPa条件下,容积为VL某密闭容器中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);CO的转化率与温度、压强的关系如图所示.
①该反应的△H______(填“<”、“>”或“=”).
②100℃时该反应的平衡常数K=______(用含a、V的代数式表示).
③在温度容积不变的情况下,向该密闭容器再增加amolCO与2amolH2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”),平衡常数______(填“增大”、“减小”或“不变”).

参考答案:(1)l0min时有0.1molCO生成,所以v(CO)=0.1mol100L10min=0.0001mo1?L-1?min-1.速率之比等于化学计量数之比,所以v(H2)=3v(CO)=3×0.0001mo1?L-1?min-1=0.0003mo1?L-1?min-1.
故答案为:0.0003mo1?L-1?min-1.
(2)①由图可知,压强不变,温度越高CO的转化率越低,故温度升高平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,所以正反应为放热反应,即△H<0.
故答案为:<.
②100℃,平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol.
对于反应 CO(g)+2H2(g)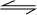 CH3OH(g);
CH3OH(g);
开始(mol):a 2a 0
变化(mol):0.5a a0.5a
平衡(mol):0.5a a 0.5a
所以平衡时 CO的浓度为0.5amolvL=a2vmol/L,H2的浓度为amolvL=avmol/L,CH3OH的浓度为0.5amolvL=a2vmol/L.
100℃时该反应的平衡常数k=c(CH3OH)c(CO)?c2(H2)=a2va2v×(av)2=v2a2.
故答案为:v2a2.
③温度容积不变,向该密闭容器再增加amolCO与2amolH2,等效为开始加入2amolCO与4amolH2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动.该反应为气体体积减小的反应,故向正反应移动,CO转化率增大.
平衡常数只受温度影响,温度不变,平衡常数不变.
故答案为:增大;不变.
本题解析:
本题难度:简单
3、计算题 合成氨工厂常通过测定反应前后混合气体的密度来确定氮的转化率。某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L。若N2、H2起始时总物质的量为1mol,求该合成氨厂N2的转化率。
参考答案:设N2、H2起始时总物质的量为1mol,其中N2为x mol,H2为(1-x)mol,
28x+2(1-x)=0.5536×22.4
x=0.4mol
N2为0.4mol,H2为0.6mol
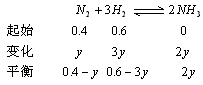
n总=0.4-y+0.6-3y+2y=(1-2y)mol
反应前后,气体总质量为一定值,则有
1×22.4×0.5536=(1-2y)×22.4×0.693
y=0.1mol
的转化率为
本题解析:
本题难度:一般
4、选择题 温度一定时, 于密闭容器中发生可逆反应: mA(气) + nB(气)  pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 .9 倍, 则下列叙述中正确的是(?)
pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 .9 倍, 则下列叙述中正确的是(?)
A.平衡向逆反应方向移动
B.C气体的体积分数增大
C.气体A的转化率升高
D.m + n > p
参考答案:A
本题解析:将混合气体的体积压缩到原来的 1/2的瞬间,C的浓度为原平衡时C的浓度的 2倍,但最终平衡时,C的浓度为原平衡时C的浓度的 1 .9 倍,这说明增大压强平衡向逆反应方向移动,则正反应是体积增大的可逆反应,所以答案选A。
点评:该题的关键是能够判断出压缩的瞬间和最终平衡时浓度的变化,从而得出平衡的移动方向。
本题难度:一般
5、填空题 1000℃时,在恒容密封容器中发生下列反应:Na2SO4(s)+4H2(g)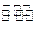 Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。
则5分钟内H2的平均反应速率为?。
(2)能说明该反应已达到平衡状态的是____(填序号)。
a.容器内压强保持不变? b.容器内气体密度保持不变
c.c(H2)=c(H2O)? d.v正(H2)=v逆(H2O)
(3)向该容器中分别加入以下物质,对平衡的影响如何?,(填“正向移动”,“逆向移动”或“不发生移动”)
①加入少量Na2SO4固体,则平衡:?②加入少量灼热的碳粉,则平衡:__?
(4)若将反应后的物质溶于水,用有关离子方程式说明上述反应产物水溶液的酸碱性___?_,欲使该溶液中S2-浓度增大,平衡逆向移动,可加入的物质是?。
参考答案:

本题解析:略
本题难度:一般