微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是(? )
A.如果盐酸的浓度是醋酸的两倍,则盐酸中的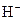 浓度也是醋酸中的两倍
浓度也是醋酸中的两倍
B.将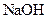 溶液和氨水各稀释一倍,两者的
溶液和氨水各稀释一倍,两者的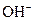 浓度均减小到原来的
浓度均减小到原来的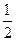
C.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸
D.弱电解质溶液的导电能力也可能比强电解质溶液的强
参考答案:D
本题解析:A项,盐酸是强电解质,完全电离,醋酸是弱电解质,部分电离,所以盐酸中的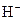 浓度大于醋酸中的两倍,A不正确。B项,稀释
浓度大于醋酸中的两倍,A不正确。B项,稀释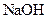 溶液和氨水,
溶液和氨水,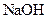 的
的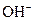 浓度减小到原来的
浓度减小到原来的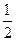 ,由于氨水是弱电解质,稀释过程电离程度增大,平衡向电离方向移动,所以氨水的
,由于氨水是弱电解质,稀释过程电离程度增大,平衡向电离方向移动,所以氨水的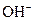 浓度大于原来的
浓度大于原来的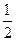 ,B不正确。C项,盐酸和醋酸溶液都是一元酸,所以中和等体积、等物质的量浓度的盐酸和醋酸溶液,所需氢氧化钠一样多,C不正确。电解质溶液的导电能力与离子浓度和离子所带的电荷数有关,与电解质的强弱无关,所以D正确。
,B不正确。C项,盐酸和醋酸溶液都是一元酸,所以中和等体积、等物质的量浓度的盐酸和醋酸溶液,所需氢氧化钠一样多,C不正确。电解质溶液的导电能力与离子浓度和离子所带的电荷数有关,与电解质的强弱无关,所以D正确。
本题难度:简单
2、选择题 下列离子能在溶液中大量共存的是( )
A.Na+、Cl-、Ba2+、SO42-
B.H+、Na+、SO32-、Cl-
C.Fe2+、Na+、Cl-、OH-
D.Na+、H+、NO3-、SO42-
参考答案:A、因Ba2+、SO42-能结合生成沉淀,则不能共存,故A错误;
B、因H+、SO32-能结合生成水和二氧化硫气体,则不能共存,故B错误;
C、因Fe2+、OH-能结合生成沉淀,则不能共存,故C错误;
D、因该组离子之间不反应,则能够共存,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 下列各组离子在溶液中能大量共存的是
A.Fe2+、NH4+、SO42—、S2—
B.Al3+、AlO2—、HCO3—、Na+
C.Ca2+、HCO3—、Cl—、K+
D. Fe3+、SCN—、Na+、CO32—
参考答案:C
本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。A中生成FeS沉淀,B中AlO2—和HCO3—分液生成氢氧化铝沉淀和CO2,D中Fe3+与SCN—、CO32—均不能大量共存,所以正确的答案选C。
点评:该题是高考中的高频题,也是高考中的常见题型。试题综合性强,侧重能力的培养。该题的关键是要明确离子不能大量共存的一般情况是,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能完全水解的离子之间;(4)能发生氧化还原反应的离子之间;(5)能发生络合反应的离子之间(如 Fe3+和 SCN-)。另外解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:简单
4、填空题 某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;将沉淀过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。
回答下列问题:
(1)原溶液中一定不存在 。
(2)根据实验和必要的计算确定溶液中一定存在的离子有哪些 (写出必要的推理及计算过程)。
参考答案:(1)CO32-(2分)(2)Fe3+、NH4+、SO42-和Cl-(2分)
本题解析:加入NaOH溶液共热有气体和红褐色沉淀,知溶液含NH4+、Fe3+,而不含CO32-,加BaCl2溶液生成不溶于盐酸的沉淀,知溶液中含SO42-。n(NH3)=0.02mol,知n(NH4+)=0.02mol,n(Fe2O3)=1.6g/160g·mol-1=0.01mol,知n(Fe3+)=0.02mol,n(BaSO4)=4.66g/233g·mol-1=0.02mol,知n(SO42-)=0.02mol,溶液中NH4+、Fe3+所带正电荷为0.02mol+3×0.02mol=0.08mol,SO42-所带负电荷为2×0.02mol=0.04mol,据电荷守恒,知溶液中必然大量存在另一种阴离子,由题意知为Cl-,综上知,原溶液中一定含Fe3+、NH4+、SO42-和Cl-。
考点:考查溶液中离子的共存和离子的判断,同时考查了电荷守恒原理的运用。
本题难度:困难
5、选择题 无色透明溶液能与铝作用放出氢气, 此溶液中一定能大量共存的离子组是( )
A.Cl-、SO42-、Na+、K+
B.K+、Cu2+-、Na+、NO3-
C.HCO3-、Na+、NO3-、K+
D.NO3-、Ba2+、Cl-、NH4+