微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下探究:
Ⅰ:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验。
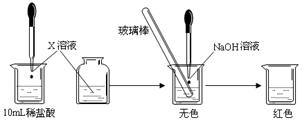
则X溶液是? ▲?。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有25.00mL稀盐酸的锥形瓶中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡,每加一滴溶液测定并记录一次溶液的pH值,直至氢氧化钠溶液过量。
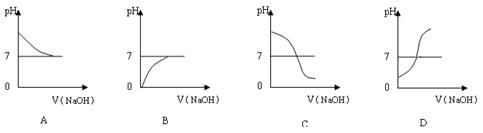
①写出测定溶液pH值的操作方法:? ▲?;
②上图中哪个图像符合该同学的记录? ▲?(填序号)。
(3)你认为甲、乙两位同学的实验中,? ▲?(填“甲同学”、“乙同学”、“甲乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由:? ▲?。
Ⅱ:丙学生用0.100 mol·L-1氢氧化钠溶液滴定未知浓度的盐酸。他用移液管准确移取25.00mL未知浓度的盐酸置于一洁净的锥形瓶中,然后用0.100 mol·L-1的氢氧化钠溶液(指示剂为酚酞)进行滴定。滴定结果如下:
滴定次数
| 盐酸的体积/mL
| ? NaOH溶液的体积/mL
|
滴定前刻度/mL
| 滴定后刻度/mL
|
? 1
| 25.00
| ? 2.00
| 20.20
|
? 2
| 25.00
| ?1.02
| 21.03
|
? 3
| 25.00
| ?0.20
| 20.20
|
(1) 根据以上数据计算出盐酸的物质的量浓度为? ▲?mol·L-1。
(2) 如果滴定的终点没有控制好,即NaOH溶液过量,溶液显深红色,如何补救?请设计实验方案。? ▲?。
参考答案:(12分)
Ⅰ.(1)酚酞(2分)
(2)①用干净的玻璃棒蘸取待测液点在pH试纸中间,将试纸的颜色与标准比色卡对照,读出溶液的pH(2分)?② D?(1分)
(3)乙同学(1分)
甲同学的实验有可能是酚酞遇氢氧化钠溶液直接变成红色,乙同学的实验,随着滴加氢氧化钠溶液,溶液的pH由小于7逐渐增大到7,这充分证明溶液中的盐酸因反应而消耗了(2分)。
Ⅱ:(1) 0.080(2分)(若0.08也给分)
(2)用上述未知浓度的盐酸进行反滴,记录所需盐酸的体积(2分)。
本题解析:略
本题难度:简单
2、实验题 (14分)某同学用图示装置进行铁和稀硝酸反应的实验并进行相关的实验探究。

a.向广口瓶内注入足量热NaOH溶液,将盛有一定质量的纯铁粉的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸人瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中缓慢滴入一定量的4mol·L-1的稀硝酸,
铁粉完全溶解。
(一)气体产物成分探究
(1)实验前如何检查该装置的气密性??。
(2)燃烧红磷的目的是?。
(3)为证明气体产物为NO,步骤c后还缺少的一步主要操作是?。
(二)产物中铁元素价态探究:
(1)提出合理假设:
假设1:产物中只有+2价铁;假设2:?,假设3:产物中既有+2价铁,又有+3价铁。
(2)设计实验方案,验证假设1成立(写出实验操作步骤、现象和结论):?。
(三)问题讨论
(1)广口瓶中热NaOH溶液的主要作用是?。
(2)若假设3成立,且所得溶液中n(Fe2+):n(Fe3+)=3:1时,则对应的离子反应方程式为?。
参考答案:(一)(1)关闭止水夹,通过分液漏斗向广口瓶中加水,当水不能顺利滴下时停止加水。观察分液漏斗中水面,若水面不下降,说明装置气密性良好;(2)除去广口瓶内空气中的氧气,避免干扰气体检验;(3)打开止水夹,向瓶内迁入少量空气(或氧气)。
(二)(1)产物中只有+3价铁;(2)取小烧杯中反应后溶液少许,放入一只试管中,滴加KSCN溶液。溶液不显红色,再向其中滴加少量的H2O2溶液,溶液显红色。则证明假设1成立。
(三)(1)实验结束后,热NaOH溶液在充入足量空气(或氧气)的条件下,将瓶中氮的氧化物完全吸收,以防止空气污染;(2)4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+5H2O
本题解析:(一)(1)实验前检查该装置的气密性的方法是关闭止水夹,通过分液漏斗向广口瓶中加水,当水不能顺利滴下时停止加水。观察分液漏斗中水面,若水面不下降,说明装置气密性良好;(2)燃烧红磷的目的是除去广口瓶内空气中的氧气,避免干扰铁和稀硝酸反应产生的气体检验;(3)为证明气体产物为NO,步骤c后还缺少的一步主要操作是打开止水夹,向瓶内迁入少量空气(或氧气),看气体是否变为红棕色,若变为红棕色,就证明产生了NO,否则没有。(二)(1)假设1:产物中只有+2价铁;假设2:产物中只有+3价铁;假设3:产物中既有+2价铁,又有+3价铁。(2)证明只有+2价铁的实验方案是取小烧杯中反应后溶液少许,放入一只试管中,滴加KSCN溶液。溶液不显红色,再向其中滴加少量的H2O2溶液,溶液显红色。则证明假设1成立。?(三)问题讨论(1)广口瓶中热NaOH溶液的主要作用是将实验结束后,在充入足量空气(或氧气)的条件下,将瓶中氮的氧化物完全吸收,以防止空气污染;(2)若产物中既有+2价铁,又有+3价铁,且所得溶液中n(Fe2+):n(Fe3+)=3:1时,根据电子守恒可得相应的离子反应方程式为4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+5H2O。
本题难度:一般
3、选择题 下述实验能达到预期目的的是
编号
| 实验内容
| 实来源:91exam .org验目的
|
A
| 将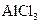 溶液蒸干 溶液蒸干
| 得到Al(OH)3
|
B
| 向沸水中滴加几滴 饱和溶液,持续续加热,并不断搅拌 饱和溶液,持续续加热,并不断搅拌
| 制备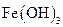 胶体 胶体
|
C
| 向某溶液中加入盐酸,将产生的气体通入澄清石灰水
| 检验溶液中是否含有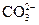
|
D
| 相同温度下,测定浓度分别为0.1mol·L-1的NaHCO3和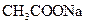 溶液的pH 溶液的pH
| 比较碳酸和醋酸电解质能力强弱
参考答案:D
本题解析:略
本题难度:一般
4、选择题 用下列实验装置进行相应实验,能达到实验目的的是
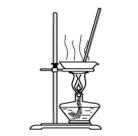 ? ?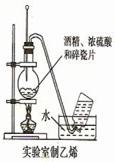 ? ?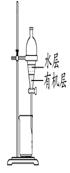 
图1?图2?图3?图4
A.用图1所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
B.用图2所示装置制取少量乙烯气体
C.用图3所示装置分离CCl4萃取溴水后已分层的有机层和水层
D.用图4所示装置制取少量Cl2气体
参考答案:C
本题解析:A.NH4Cl在加热条件下易分解,如制备氯化铵晶体,不能直接蒸干,故A错误;
B.制乙烯的温度为170度,温度计的头部应在液面之下,故B错误;
C.CCl4密度比水大,有机层在下层,故C正确;
D.制备氯气需要在加热的条件下,故D错误。
故选C。
点评:本题考查物质的分离、提纯以及制备等实验操作,题目难度不大,解答该类题目的关键是能正确把握相关物质的性质。
本题难度:一般
5、简答题 锗(Ge)是第ⅣA族元素,它的单质是一种良好的半导体材料,被广泛地应用在电子工业上,锗可以从烟道灰中提取,其过程如下:

(1)写出上述各步反应的化学方程式①______;②______;③______;④______.
(2)提取过程中①至③的作用是什么?从节约资源角度考虑哪一步的产物可以循环使用?
参考答案:(1)①锗最外层有4个电子,所以其最高价为+4,锗的最高价氧化物为GeO2,与HCl(aq)发生复分解反应,生成的氯化物应为GeCl4和H2O,反应方程式为:GeO2+4HCl═GeCl4+2H2O.
故答案为:GeO2+4HCl═GeCl4+2H2O.
②GeCl4水解反应:GeCl4+4H2O

Ge(OH)4+4HCl(正反应吸热),生成原锗酸H4GeO4与HCl,原锗酸H4GeO4失水变为锗酸H2GeO3,反应方程式为GeCl4+4H2O═H4GeO4+4HCl、H4GeO4═H2GeO3+H2O(或GeCl4+3H2O═H2GeO3+4HCl?)
故答案为:GeCl4+4H2O═H4GeO4+4HCl、H4GeO4═H2GeO3+H2O(或GeCl4+3H2O═H2GeO3+4HCl?).
③GeCl4水解反应:GeCl4+4H2O

Ge(OH)4+4HCl(正反应吸热),生成原锗酸H4GeO4与HCl,加热平衡向右移动,HCl逸出,且水分不断蒸发,原锗酸H4GeO4失水变为锗酸H2GeO3,H4GeO4失水变为锗酸H2GeO3,锗酸受热分解为GeO2.
锗酸受热分解为GeO2与水,反应方程式为H2GeO3??△?.?GeO2+H2O.
故答案为:H2GeO3??△?.?GeO2+H2O.
④GeO2与H2发生氧化还原反应,H2夺去GeO2中的O生成H2O,Ge被还原出来.反应方程式为GeO2+2H2?△?.?Ge+2H2O.
故答案为:GeO2+2H2?△?.?Ge+2H2O.
(2)前三步的主要作用是分离、提纯和富集锗的氧化物.
第②步中产生的盐酸可以循环到第①步中使用,①③④中产生的水也可以循环到第②步使用.
故答案为:前三步的主要作用是分离、提纯和富集锗的氧化物.
第②步中产生的盐酸可以循环到第①步中使用,①③④中产生的水也可以循环到第②步使用.
本题解析:
本题难度:一般
|