| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《离子方程式的书写及正误判断》高频考点巩固(2017年模拟版)(四)
参考答案: 本题解析: 本题难度:一般 2、选择题 下列化学方程式中,能用离子方程式:Ba2++ SO42-= BaSO4↓表示的是 |
参考答案:D
本题解析:Ba2++ SO42-= BaSO4↓表示可溶性钡盐与可溶性硫酸盐或H2SO4反应,Ba(OH)2 + (NH4)2SO4 =BaSO4↓ + 2NH3?H2O,氨水是弱碱,不能删除,A项错误;Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O,水是弱电解质,不能删除,B项错误;BaCO3 + H2SO4 ="=" BaSO4↓ + 2H2O + CO2↑,BaCO3是难溶盐,写化学式,C项错误;BaCl2 + Na2SO4 ="=" BaSO4↓ + 2NaCl符合题意,D项正确;选D。
考点:考查离子方程式的意义。
本题难度:一般
3、选择题 下列各离子方程书写正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++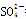 ===BaSO4↓+H2O
===BaSO4↓+H2O
B.将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
C.在FeI2溶液中通入少量的氯气:2Fe2++ Cl2 = 2Fe3+ + 2Cl-
D.Fe(OH)3与足量的HI溶液反应: Fe(OH)3+3H+=Fe3++3H2O
参考答案:B
本题解析:A、H2SO4与Ba(OH)2溶液反应应为:Ba2++2OH-+2H++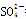 ===BaSO4↓+2H2O,错误;B、将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑,正确;C、还原性:I->Fe2+,FeI2溶液中通入少量的氯气:2 I- + Cl2 = 2Fe3+ + I2,错误;D、Fe(OH)3与足量的HI溶液反应,漏掉碘离子和铁离子之间的氧化还原反应,错误。
===BaSO4↓+2H2O,错误;B、将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑,正确;C、还原性:I->Fe2+,FeI2溶液中通入少量的氯气:2 I- + Cl2 = 2Fe3+ + I2,错误;D、Fe(OH)3与足量的HI溶液反应,漏掉碘离子和铁离子之间的氧化还原反应,错误。
考点:考查离子方程式正误判断。
本题难度:一般
4、选择题 下列图示与对应的叙述相符的是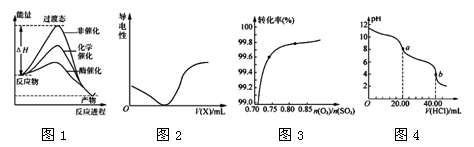
A.由图1所示曲线可知,化学催化比酶催化的效果好
B.在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X为Cl2
C.在其它条件不变时,2SO2(g)+ O2(g) 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率
2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率
D.图4是用0.l000 mol·L-1的盐酸滴定20.00 mL 0.l000mol·L-1 Na2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+= CO2↑+H2O
参考答案:D
本题解析:A.由图1所示曲线可知,酶使反应的活化能大大降低,化学反应速率大大加快,因此化学催化不如酶催化的效果好,错误;B.在H2S溶液导电性实验中,开始加入Cl2,会发生反应:H2S+ Cl2=2HCl+S↓,由于H2S是弱酸,HCl是强酸,加入后溶液的导电性应该加强,不是减弱,因此由图2所示曲线可确定通入的气体X不是Cl2,错误;C.在其它条件不变时,2SO2(g)+ O2(g) 2SO3(g)转化关系(图3)中,可知混合气体中氧气的含量越大,则SO2的转化率就越大,所以纵坐标表示SO2的转化率,错误;D.Na2CO3是强碱弱酸盐,水解是溶液显酸性,随着盐酸的滴加,不断发生反应Na2CO3,溶液的碱性减弱,pH不断减小,当滴加20.00ml盐酸时物质变为NaHCO3和NaCl,此后再滴加盐酸,从a→b点反应的离子方程式为:HCO3-+H+= CO2↑+H2O,正确。
2SO3(g)转化关系(图3)中,可知混合气体中氧气的含量越大,则SO2的转化率就越大,所以纵坐标表示SO2的转化率,错误;D.Na2CO3是强碱弱酸盐,水解是溶液显酸性,随着盐酸的滴加,不断发生反应Na2CO3,溶液的碱性减弱,pH不断减小,当滴加20.00ml盐酸时物质变为NaHCO3和NaCl,此后再滴加盐酸,从a→b点反应的离子方程式为:HCO3-+H+= CO2↑+H2O,正确。
考点:考查图像法再表示化学反应过程及反应原理的应用的知识。
本题难度:一般
5、填空题 写出下列化学方程式或离子方程式(6分)
①碳与浓硫酸共热的化学方程式: .
②实验室制取氨气的化学方程式: .
③过量的二氧化碳与氢氧化钠溶液反应的离子方程式: .
参考答案:(1)C+2H2SO4(浓)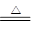 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(2)Ca(OH)2+2NH4Cl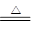 CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
(3)CO2+OH-=HCO3-
本题解析:浓硫酸在加热的条件下能把碳氧化生成CO2,而硫酸被还原生成SO2和水。实验室制取氨气利用的是熟石灰和氯化铵加热生成。过量的CO2和氢氧化钠反应生成的碳酸氢钠。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《原子晶体》.. | |