微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质可用做半导体材料的是
A.二氧化硅
B.粗硅
C.高纯硅
D.硅酸盐
参考答案:C
本题解析:用作半导体的材料,需要有整齐的晶格,有空穴,受激发能有电子挣脱共价键而溢出变成自由电子。而二氧化硅、硅酸盐没有这样的晶格,粗硅因为杂质太多也不能胜任,只有很纯的单晶硅才可以。故选C。
本题难度:困难
2、选择题 将2molNaHCO3和一定量Na2O2固体混合,在加热条件下让其充分反应,150℃时所得气体中仅含有两种组分,则反应后固体的物质的量n的取值范围是
A.n=1mol
B.1molC.2molD.n≥4mol
参考答案:C
本题解析:2NaHCO3===(△)Na2CO3+CO2↑+H2O↑;2molNaHCO3生成1mol CO2和1mol H2O、1mol Na2CO3,Na2O2固体与混合气体反应可看成是先与CO2反应,反应完后再与H2O反应。
2Na2O2+2CO2="2" Na2CO3+ O2↑;2Na2O2+2 H2O ="4NaOH+" O2↑;要求反应后气体中含有两种组分,则两组分为氧气和水蒸气;过氧化钠与二氧化碳反应消耗的物质的量为1mol,生成Na2CO3的物质的量为1mol,若1mol H2O全部与Na2O2反应则生成2 mol NaOH,所以反应后固体的物质的量n的取值范围是2mol<n<4mol;
本题难 www.91eXam.org度:一般
3、选择题 把一定量的Na2O2的NaHCO3的混合粉末分为两等份,将其中一份加入100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标准状况下);再将此气体通入另一份混合物中,充分反应后,得到O2?2.016L(标准状况下),则原混合粉末中Na2O2和NaHCO3的物质的量之比及稀盐酸的物质的量浓度是
A.A
B.B
C.C
D.D
参考答案:D
本题解析:分析:第一份发生反应①2Na2O2+4HCl=4NaCl+2H2O+O2 ;②NaHCO3+HCl=NaCl+H2O+CO2,生成气体为O2与CO2.
将第一份生成的干燥气体,通入第二份Na2O2的NaHCO3的混合粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,根据二氧化碳是否过量用讨论的方法计算.
解答:2.24L混合气体的物质的量为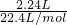 =0.1mol;
=0.1mol;
2.016LO2的物质的量为 =0.09mol.
=0.09mol.
2Na2O2+2CO2=2Na2CO3+O2 △n
2? 2? 1
n?m? 0.1mol-0.09mol=0.01mol
n=m=0.02mol,
1、若CO2完全反应,则第一份生成CO2的为0.02mol,O2为0.1mol-0.02mol=0.08mol
2? Na2O2+4? HCl=4NaCl+2H2O+O2
0.16mol? 0.32mol?0.08mol
?NaHCO3+HCl=NaCl+H2O+CO2
0.02mol 0.02mol? 0.02mol
所以Na2O2为0.16mol,NaHCO3为0.02mol;混合物中Na2O2与NaHCO3的物质的量之比0.16mol:0.02mol=8:1;
消耗的HCl为0.32mol+0.02mol=0.34mol,物质的量浓度为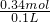 =3.4mol/L.
=3.4mol/L.
2、若CO2未完全反应,则Na2O2应是0.02 mol,
2Na2O2+4HCl=4NaCl+2H2O+O2
0.02mol 0.04mol? 0.01mol
则第一份生成O2的为0.01mol,所以CO2为0.1mol-0.01mol=0.09mol.
NaHCO3+HCl=NaCl+H2O+CO2
0.09mol 0.09mol?0.09mol
所以Na2O2为0.02mol,NaHCO3为0.09mol;混合物中Na2O2与NaHCO3的物质的量之比0.02mol:0.09mol=2:9.
消耗的HCl为?0.04mol+0.09mol=0.13mol,物质的量浓度为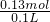 =1.3mol/L.
=1.3mol/L.
故选:D.
点评:本题考查混合物的计算,难度较大,关键是二氧化碳与过氧化钠的反应讨论进行计算.
本题难度:一般
4、选择题 物质X是某反应中的生成物,其质量先增大后减小,下列各操作中指定物质数量变化符合此特征的是
A.A
B.B
C.C
D.D
参考答案:A
本题解析:分析:A、向NaClO溶液中通入SO2,生成的Na2SO3质量增大,继续通入生成亚硫酸氢钠;
B、向Na2CO3溶液中滴加盐酸,反应过程中氯化钠质量增多;
C、向NaHCO3溶液中滴加石灰水,开始生成碳酸钙和碳酸钠,继续滴加碳酸钠减小;
D、向KBr溶液中滴加稀氯水,反应过程中生成溴单质质量增大后不变.
解答:A、向NaClO溶液中通入SO2,生成的Na2SO4,继续通入质量不变,故A不符合;
B、向Na2CO3溶液中滴加盐酸,生成碳酸氢钠和氯化钠,继续滴加反应过程中氯化钠质量增多,故B不符合;
C、向NaHCO3溶液中滴加石灰水,开始生成碳酸钙和碳酸钠,继续滴加碳酸钠减小,故C符合;
D、向KBr溶液中滴加稀氯水,反应过程中生成溴单质质量增大后不变,故D不符合;
故选C.
点评:本题考查了钠及其化合物性质的应用,注意反应过程中量不同产物不同,物质性质是解题的关键,题目难度中等.
本题难度:一般
5、选择题 下列氢氧化物中,受热最不易分解的是
A.Fe(OH)3
B.Cu(OH)2
C.NaOH
D.Al(OH)3
参考答案:C
本题解析:试题分析:大多数金属氢氧化物受热易分解为氧化物和水,而活泼金属(如K、Ca、Na等)的氢氧化物不易分解。A项Fe(OH)3受热易分解为Fe2O3和H2O,B项Cu(OH)2受热易分解为CuO和H2O,D项Al(OH)3易分解为Al2O3和H2O,只有C项 NaOH 受热不易分解。?
考点:考查常见金属氢氧化物的热稳定性
点评:熟悉金属氢氧化物的性质,此题属于简单题型
本题难度:简单