微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在以下物质间的多步转化过程中,其中含有不能通过一步反应实现的是
A.Fe→FeCl2→Fe(OH)2→Fe(OH)3
B.Al→Al2O3→Al(OH)3→NaAlO2
C.S→SO2→H2SO4→MgSO4
D.N2→NO→NO2→HNO3
参考答案:B
本题解析:分析:A、铁和盐酸反应生成氯化亚铁,再和烧碱反应可得氢氧化亚铁,进而被氧气氧化为氢氧化铁;
B、铝在氧气中反应生成氧化铝,氧化铝不溶于水,不能生成氢氧化铝,氢氧化铝能和烧碱反应生成偏铝酸钠盐;
C、硫和氧气生成二氧化硫,二氧化硫可以一步生成硫酸,硫酸和镁反应生成硫酸镁;
D、氮气和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮;
解答:A、Fe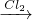 FeCl2
FeCl2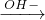 Fe(OH)2
Fe(OH)2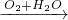 Fe(OH)3,可以一步实现,故A不符合;
Fe(OH)3,可以一步实现,故A不符合;
B、Al Al2O3→不能一步实现转化为氢氧化铝;Al(OH)3
Al2O3→不能一步实现转化为氢氧化铝;Al(OH)3 NaAlO2,故B符合;
NaAlO2,故B符合;
C、S SO2→
SO2→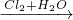 H2SO4
H2SO4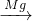 MgSO4,故C不符合;
MgSO4,故C不符合;
D、N2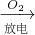 NO
NO NO2
NO2 HNO3,故D不符合;
HNO3,故D不符合;
故选B.
点评:本题涉及物质之间的转化知识,可以根据所学的知识来回答,明确物质的性质是解答本题的关键.
本题难度:简单
2、选择题 镁、铝、铜组成的混合物10.3克,在空气中充分加热至恒重,质量变为13.5克.如果将所得固体溶解,需要消耗6mol?L-1的硫酸
A.0.1mol
B.0.2mol
C.50mL
D.60mL
参考答案:B
本题解析:分析:镁、铝、铜组成的混合物在空气中充分加热至恒重,生成金属氧化物,固体增加的质量3.2g是氧元素的质量,金属氧化物与硫酸反应生成硫酸盐与水,水中氧原子来源于金属氧化物,水中氢原子来源于硫酸,利用氧原子计算生成的水的物质的量,根据水计算参加反应的硫酸的物质的量,据此计算消耗硫酸溶液体积.
解答:镁、铝、铜组成的混合物在空气中充分加热至恒重,生成金属氧化物,固体增加的质量13.5g-10.3g=3.2g是氧元素的质量,所以氧原子的物质的量为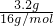 =0.2mol.
=0.2mol.
金属氧化物与硫酸反应生成硫酸盐与水,水中氧原子来源于金属氧化物,根据氧原子守恒,生成水的物质的量为0.2mol.
水中氢原子来源于硫酸,根据氢原子守恒可知,参加反应硫酸的物质的量为0.2mol.
所以需要消耗6mol?L-1的硫酸的体积为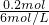 =0.033L=33ml.
=0.033L=33ml.
故选:B.
点评:考查混合物的有关计算,难度中等,关键判断固体增加的质量是氧元素的质量及根据守恒计算,用常规方法无法计算.是对学生综合能力的考查.
本题难度:困难
3、选择题 将CO2通入含溶质0.8g?NaOH的溶液中,将充分反应后的溶液减压蒸发,得到1.37g固体,则通入CO2的质量是
A.0.44g
B.0.66g
C.0.88g
D.都不是
参考答案:B
本题解析:分析:首先根据NaOH的质量和固体的质量判断反应产物的成分,进而根据反应的方程式计算.
解答:设0.8g氢氧化钠全部生成碳酸钠,质量为x,则有
2NaOH+CO2=Na2CO3+H2O
80? 106
0.8g? x
x=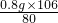
x=1.06g,
设0.8g氢氧化钠全部生成碳酸氢钠,质量为y,则有
NaOH+CO2=NaHCO3
40?84
0.8g? y
y=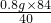
y=1.68g,
而题干中给出的物质的质量为1.37g,所以有一部分氢氧化钠转化生成了碳酸氢钠,
故产物为碳酸钠和碳酸氢钠的混合物,
设混合物中含有mmolNa2CO3,nmolNaHCO3,
2NaOH+CO2=Na2CO3+H2O
?2m? m? m
NaOH+CO2=NaHCO3
n? n? n
则有:2m+n=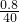 ,106m+84n=1.37,
,106m+84n=1.37,
解之得:m=0.005,n=0.01,
通入CO2的质量为:(0.005+0.01)mol×44g/mol=0.66g,
故选B.
点评:本题考查化学方程式的计算,根据反应物的量判断生成物的组成为解答该题的关键,题目难度中等.
本题难度:一般
4、选择题 在一定条件下,将金属钠与氧气反应的生成物7.0g溶于水,所得溶液恰好被100g?质量分数为9.8%的硫酸溶液完全中和,则该氧化物的成分为
A.Na2O
B.Na2O2
C.Na2O和Na2O2
D.NaO2和Na2O2
参考答案:C
本题解析:分析:由于不知道产物是 Na2O还是Na2O2,或者二者都有,因此设定一个化学式Na2OX,算出摩尔质量,与两种氧化物的对比即可判断.
解答:n(硫酸)=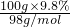 =0.1mol,
=0.1mol,
溶液恰好能被100g?质量分数为9.8%的硫酸溶液中和,
则? Na2OX ~2NaOH~H2SO4
?0.1mol?0.1mol
则Na2OX平均摩尔质量M=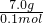 =70g/mol,介于Na2O(62g/mol)和Na2O2(78g/mOl)之间,因此,一定条件下钠与氧气反应的生成物是Na2O 和Na2O2,
=70g/mol,介于Na2O(62g/mol)和Na2O2(78g/mOl)之间,因此,一定条件下钠与氧气反应的生成物是Na2O 和Na2O2,
故选C.
点评:本题主要考查的钠与氧气反应产物的判断,若用极限法计算,计算比较繁琐,而用平均摩尔质量来求,则比较简单.
本题难度:简单
5、选择题 相同物质的量铝,分别跟足量的盐酸和氢氧化钠溶液反应,生成氢气的体积比为
A.1:1
B.1:2
C.2:3
D.3:4
参考答案:A
本题解析:分析:根据铝与足量的氢氧化钠溶液和稀盐酸反应的化学方程式可知,酸、碱足量时,铝完全反应,则铝的质量相等生成的氢气也相等.
解答:由2Al+6HCl=2AlCl3+3H2↑、2Al+2H2O+2NaOH=2NaAlO2+3H2↑可知,
酸、碱均过量,则铝完全反应,
铝的物质的量相等,从方程式中可以看到铝与氢气的比例都是2:3,
因此产生的氢气是相等的,生成氢气的体积比为1:1,
故选A.
点评:本题主要考查了铝与酸、碱的反应,明确铝与氢氧化钠的反应方程式及Al的物质的量相同是解题关键,题目难度中等.
本题难度:简单