微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
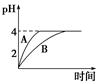
(1)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”)。设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为m2,则m1________m2(选填“<”、“=”或“>”)。
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加NaOH溶液,使溶液pH为________。
(3)10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃
| 10
| 20
| 30
| 加热煮沸后冷却到50 ℃
|
pH
| 8.3
| 8.4
| 8.5
| 8.8
|
?
在分析该溶液pH增大的原因时,甲同学认为是升高温度HCO3-的水解程度增大所致;乙同学认为是溶液中升高温度NaHCO3受热分解生成Na2CO3,CO32-水解程度大于HCO3-所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)________________________________________________________________________。
参考答案:(1)B < (2)5 6 (3)向溶液中加入足量BaCl2(或CaCl2)溶液,如果无白色沉淀生成说明甲正确,有白色沉淀产生说明乙正确
本题解析:(1)醋酸溶液中存在CH3COOH CH3COO-+H+平衡,随着反应的进行,平衡右移,所以醋酸溶液中c(H+)变化速率慢,所以B表示醋酸;pH由2升高到4时,醋酸提供的H+的物质的量多,消耗的Zn多;(2)依Ksp=c(Cu2+)·c2(OH-)可知c2(OH-)=
CH3COO-+H+平衡,随着反应的进行,平衡右移,所以醋酸溶液中c(H+)变化速率慢,所以B表示醋酸;pH由2升高到4时,醋酸提供的H+的物质的量多,消耗的Zn多;(2)依Ksp=c(Cu2+)·c2(OH-)可知c2(OH-)=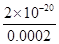 ,c(OH-)=10-9 mol·L-1;c02(OH-)=
,c(OH-)=10-9 mol·L-1;c02(OH-)=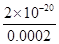 ?mol·L-1,c0(OH-)=10-8 mol·L-1;(3)甲与乙的区别就是是否有CO32-生成,本题就转化为检验溶液中是否有CO32-。
?mol·L-1,c0(OH-)=10-8 mol·L-1;(3)甲与乙的区别就是是否有CO32-生成,本题就转化为检验溶液中是否有CO32-。
本题难度:一般
2、选择题 常温时,下列各组离子在指定溶液中能大量共存的是
[? ]
A.pH = 1的溶液中:Fe2+、NO3-、SO42-、Na+
B.c(Fe3+) = 0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN-
C.c(H+)/c(OH-) = 1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.由水电离的c(H+) = 1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
参考答案:C
本题解析:
本题难度:一般
3、填空题 某溶液中可能有下列阴离子中的一种或几种:SO42-、CO32-、Cl-。
(1)当溶液中有大量H+存在时,则不可能有______存在。
(2)当溶液中有大量Ba2+存在时,溶液中不可能有_______存在
(3)当溶液中有__________和_________存在时,上述所有阴离子都不可能存在。
参考答案:(1)CO32-
(2)SO42-、CO32-
(3)Ba2+;Ag+
本题解析:
本题难度:一般
4、选择题 在pH=0的溶液中,能大量共存的离子组是
A.Na+、Mg2+、NO3-、SO42-
B.K+、Ca2+、CH3COO-、HCO3-
C.Fe2+、Na+、Cl-、NO3-
D.Ba2+、AlO2-、K+、SO42-
参考答案:A
本题解析:略
本题难度:一般
5、选择题 室温时,向稀醋酸中逐滴加入NaOH溶液,正确的是:
A.向原醋酸中滴入NaOH溶液,可促进CH3COOH的电离,溶液的pH降低
B.当滴入的NaOH与CH3COOH恰好反应时,所得溶液呈中性
C.当两者恰好完全反应时: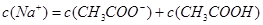
D.所得溶液中各离子浓度的关系为:
参考答案:CD
本题解析:氢氧化钠中和醋酸电离出的氢离子,崔健醋酸电离,但溶液的酸性降低。二者恰好反应时,生成物是醋酸钠,醋酸钠水解显碱性,B不正确。C中符合物料守恒,正确。D中符合电荷守恒,正确,答案选CD。
本题难度:简单