微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在一固定容积的密闭容器中,保持一定温度,在一定条件下进行反应:A(g)+2B(g)?3C(g),已知加入1mol A和3mol B且达平衡后生成a?mol C,
回答下列问题:
(1)平衡时C在反应混合气体中的体积分数是?(用字母a表示).
(2)在相同实验条件下,若在同一容器中改为加入2mol A和6mol B,达平衡后,C的物质的量为?mol(用字母a表示).此时C在反应混合气中的体积分数?(填增大、减少或不变).
(3)在相同实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合气中的体积分数不变,则还应加入C?mol.
(4)在同一容器中加入n?molA和3n?molB,在平衡时C的物质的量为mmol,若改变实验条件,可以使C的物质的量在m~2m之间变化,那么n与m的关系应是?(用字母m、n表示).
参考答案:
本题解析:
本题难度:一般
2、选择题 对于可逆反应:A2(g)+3B2(g)  2AB3(g)?△H<0,下列图像正确的是(?)
2AB3(g)?△H<0,下列图像正确的是(?)
(友情提示:V-速率;? W(AB3)-AB3的质量分数)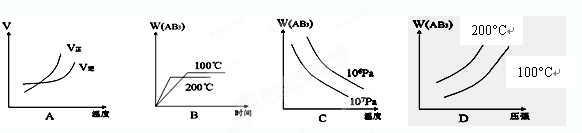
参考答案:B
本题解析:正反应是放热反应,升高温度,正、逆反应速率均加快,平衡向逆反应方向移动,W(AB3)减小,A错误、B正确、D错误;增大压强,平衡向正反应方向移动,W(AB3)增大,C错误。
点评:解图像题要看清图像中横坐标、纵坐标的涵义及图像中曲线的走向和位置高低。
本题难度:简单
3、选择题 质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
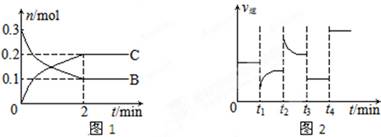
下列有关说法正确的是(?)
A.x=2,反应开始2 min内,v(B)=0.1 mol/(L·min)
B.t1时改变的条件是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
参考答案:D
本题解析:
【错解分析】错选A或C,错选A,当 x=2时,v(B)=(0.3-0.1)/2="0.1" mol/(L·min);错选C,若增大c(C),反应将向逆反应方向移动,B的物质的量增大,所以B的物质的量分数增大。错选A是没有看清楚图,纵轴表示物质的物质的量,而反应速率的公式中分子是浓度的变化;错选C是模糊了物质的量和物质的量分数之间的关系,物质的量增加并不意味着物质的量分数增加。
【正解】本题主要涉及化学平衡图象的识别和判断,图1是浓度-时间图,图2为速率-时间图,A中,当 x=2时,v(B)=(0.3-0.1)/2/2="0.05" mol/(L·min),B中此反应△H<0,降温平衡正向移动。C中结合图2逆反应速率增大,平衡逆向移动,B的物质量增大,但是总的物质的量也在增大,所以无法确定B的物质的量分数不一定增大。D项中改变压强,平衡不移动,使用催化剂,平衡亦不移动。
本题难度:简单
4、选择题 反应 X(气)+ Y(气) 2Z(气);△H=Q(Q<0)在一定条件下,反应物Y的转化率与反应时间(t)的关系如下图所示。若使曲线a变为曲线b可采取的措施是
2Z(气);△H=Q(Q<0)在一定条件下,反应物Y的转化率与反应时间(t)的关系如下图所示。若使曲线a变为曲线b可采取的措施是
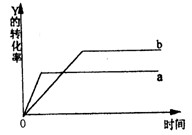
A.加催化剂
B.降低温度
C.增大压强
D.增大Y的浓度
参考答案:B
本题解析:A 错误 催化剂只能改变平衡达到的时间,不能改变反应物的转化率
B正确降低温度,平衡右移,Y的转化率增大,而温度越低反应速率越慢,达平衡所需时间越长
C 错误该反应为气体体积数不变的反应,故增大压强只能加快反应速率,缩短达平衡所需时间,不能改变反应物的专化率
D增大Y的浓度,可提高X的转化率,而自身的转化率会减小
本题难度:简单
5、填空题 物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)____________________________________。
(3)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s) Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
参考答案:(8分) (每空2分)
(1)c(NH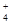 )>c(SO
)>c(SO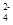 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
(2)HCO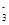
 H++CO
H++CO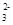 ;HCO
;HCO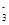 +H2O
+H2O H2CO3+OH-;
H2CO3+OH-;
(3)②①③ ;? 6×10-10mol·L-1
本题解析:(1)铵根离子水解,溶液呈酸性,c(H+)>c(OH-),.1mol?L-1的(NH4)2SO4溶液中,铵根离子水解微弱,所以得到溶液中的离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-)。
(2)在NaHCO3溶液中存在碳酸氢根离子的水解平衡为:HCO3+H2O H2CO3+OH-,电离平衡为:HCO3-
H2CO3+OH-,电离平衡为:HCO3- H++CO32-;水的电离平衡,H2O
H++CO32-;水的电离平衡,H2O H++OH-。
H++OH-。
(3)Ksp=1.8×10-10mol2?L-2=C(Ag+)?C(Cl-),通过计算分别得到:①100mL蒸馏水中含银离子浓度和氯离子浓度相同;②100mL 0.2mol?L-1AgNO3溶液中Ag+浓度为0.2mol/l抑制沉淀溶解平衡,氯离子浓度=1.8×10-10÷0.2=9×10-10mol/L;③100mL 0.1mol?L-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度=6×10-10mol/L;④100mL 0.1mol?L-1盐酸溶液中氯离子浓度为0.1mol/L,银离子为1.8×10-9mol/L;综上所述大小顺序为:②①④③;②中氯离子的浓度9×10-10 mol/L;,③中银离子的浓度:6.0×10-10mol/L。
点评:本题考查了盐类水解的应用,溶液中离子浓度大小的比较,溶液中平衡的分析,溶液配制,溶度积的计算应用。
本题难度:一般