微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 一定温度下在某2L密闭容器中加入5molSO2和3molO2,当反应达到平衡时,有3molSO2发生了反应,则:
(1)生成了______molSO3,SO2的转化率为______.
(2)平衡时容器内气体的总物质的量为______.
(3)平衡时SO2的浓度是______,O2的物质的量是______,SO3的质量是______.
(4)若向甲、乙、丙、丁四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小排列的顺序正确的是______
甲:在500℃时,8molSO2和5mol?O2反应
乙:在500℃时,SO2和O2各10mol反应
丙:在450℃时,8molSO2和5mol?O2反应
丁:在500℃时,用V2O5作催化剂,10molSO2和5mol?O2反应.
参考答案:利用三段式法计算:
? ? 2SO2(g)+O2?(g)?

?2SO3(g),
起始:5mol? 3mol? 0
转化:3mol? 1.5mol? 3mol
平衡:2mol? 1.5mol? 3mol
(1)达平衡时生成3molSO3,SO2的转化率为3mol5mol×100%=60%,
故答案为:3;60%;
(2)平衡时容器内气体的总物质的量为2mol+1.5mol+3mol=6.5mol,
故答案为:6.5mol;
(3)平衡时SO2的浓度为=2mol2L=1mol/L,达平衡时O2的物质的量为1.5mol,
SO3的质量是3mol×80g/mol=240g,故答案为:1mol/L;1.5mol;240g;
(4)比较甲、乙,温度同,只有初始浓度不同,乙的浓度大于甲的浓度,所以反应速率乙>甲;
比较乙、丁,温度,初始浓度同,丁使用催化剂,所以反应速率丁>乙;
比较甲、丙,初始浓度同,温度不同,甲的温度高于丙的温度,所以反应速率甲>丙,故反应速率由大到小排列的顺序是丁、乙、甲、丙,
故答案为:丁、乙、甲、丙.
本题解析:
本题难度:一般
2、简答题 (1)已知Na2S2O3+H2SO4═NaSO4+S↓+SO2+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如表(所取溶液体积均为10mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1
①
25
0.1
0.1
②
25
0.2
0.1
③
25
0.1
0.2
④
50
0.2
0.1
⑤
50
0.1
0.1
|
其他条件不变时:探究温度对化学反应速率的影响,应选择实验______(填实验编号);
若同时选择实验①、实验②、实验③,测定混合液变浑浊的时问,可探究______对化学反应速率的影响.
(2)某同学设计如图实验流程探究Na2S2O3的化学性质.
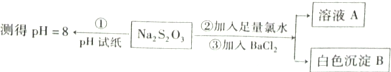
用离子议程式表示Na2S2O3溶液具有碱性的原因______,实验操作①中测试时pH试纸的颜色应该接近______.
A.红色B.深蓝色C.黄色D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的______性.
参考答案:(1)其他条件不变探究温度对化学反应速率的影响时,要让浓度保持一致,温度成为唯一变量,①⑤和②④这两组浓度一致,因此可选①⑤或②④,实验①、实验②和实验③的温度相同,浓度不同,因此探究的是浓度对化学反应速率的影响,
故答案为:①⑤或②④;比较改变不同反应物的浓度对反应速率的影响;
(2)Na2S2O3属于强碱弱酸盐,在水溶液中可以发生水解,水解的离子方程式为:S2O32-+H2O?HS2O3-+OH-;PH=8对应标准比色卡对应的颜色为绿色;白色沉淀B为硫酸钡,加入氯水的目的是把S2O32-氧化为硫酸根离子,表现了Na2S2O3的还原性,
故答案为:S2O32-+H2O?HS2O3-+OH-;D;还原.
本题解析:
本题难度:一般
3、填空题 可逆反应:aA(g)+bB(g) cC(g)+dD(g);ΔH=Q,试根据图回答:
cC(g)+dD(g);ΔH=Q,试根据图回答:

(1)压强p1比p2________(填“大”、“小”)。
(2)(a+b)比(c+d)________(填“大”、“小”)。
(3)温度t1℃比t2℃________(填“高”、“低”)。
(4)Q值是________(填“正”、“负”)。
参考答案:(1)小 (2)小 (3)高 (4)正
本题解析:(1)据图(A)可知p2>p1,由p1→p2为增大压强,结果A的转化率减小,说明平衡向逆反应方向移动,故逆反应为气体体积减小的反应,即a+b<c+d。
(2)据图(B)可知,t1>t2,由t2→t1为升温,结果A的含量减小,说明平衡向正反应方向移动,故正反应为吸热反应,即Q>0。
本题难度:一般
4、选择题 在C(s)+CO2(g) 2CO(g)反应中可使反应速率增大的措施是
2CO(g)反应中可使反应速率增大的措施是
①减小容器体积使增大压强 ? ②增加碳的量 ? ③恒容时通入CO2
④恒压下充入N2 ? ⑤恒容下充入N2
A.①③⑤
B.②④
C.①③
D.③⑤
参考答案:C
本题解析:①减小容器体积使增大压强,则气体的浓度增大,反应速率增大;②碳为固体,增加碳的量几乎不影响反应速率;③恒容时通入CO2,使CO2浓度增大,反应速率增大;④恒压下充入N2,体积增大,是容器内CO2浓度减小,反应速率减小;⑤恒容下充入N2,气体浓度不变,反应速率不影响。
本题难度:一般
5、选择题 对于SO2的氧化反应:2SO2+O2 2SO3,下列说法错误的是( )
2SO3,下列说法错误的是( )
A.使用合适的催化剂可以加大反应速率
B.采用过量的O2可以使SO2全部转化为SO3
C.升高温度可以增大反应速率
D.增大O2浓度可以增大反应速率
参考答案:A、使用合适的催化剂,降低反应的活化能而加快反应速率,故A正确;
B、可逆反应具有不完全转化性,则转化率小于100%,即过量的O2不能使SO2全部转化为SO3,故B错误;
C、升高温度,活化分子百分数增加,有效碰撞增多,导致反应速率加快,故C正确;
D、增大浓度,增加单位体积内的活化分子数,反应速率加快,故D正确.
故选B.
本题解析:
本题难度:一般