微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于Cl、N、S等非金属元素化合物的说法正确的是( )
A.漂白粉的成分是次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH?处理Cl2?和HCl?废气
D.Al2(SO4)3?可除去碱性废水及酸性废水中的悬浮颗粒
参考答案:A.漂白粉的主要成分是氯化钙、次氯酸钙,有效成分为次氯酸钙,故A错误;
B.浓硫酸与氨气反应,则实验室不可用浓硫酸干燥氨气,故B错误;
C.氯气、HCl与NaOH都反应,则实验室可用NaOH?处理Cl2和HCl废气,故C正确;
D.酸性废水中Al2(SO4)3?无法得到胶体,胶体能除去废水中的悬浮颗粒,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 在一定条件下,下列物质①CO2,②Cl2,③浓硝酸,④NH3,⑤FeCl3,其中能跟某些金属、非金属、酸、碱都能发生反应的是( )
A.①④
B.②③
C.①④⑤
D.②③⑤
参考答案:①CO2能与镁、碳、碱反应,但不能与酸反应,故①错误;
②Cl2能与钠、氢气、亚硫酸、碱反应,故②正确;
③浓硝酸能与铜、碳、氢碘酸、碱反应,故③正确;
④NH3能与氧气、氯气、酸反应,不能碱反应,故④错误;
⑤FeCl3能与铁、氢硫酸,碱反应,不能与非金属反应,故⑤错误;
故选:B.
本题解析:
本题难度:简单
3、选择题 硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤。在无机非金属材料中,硅一直扮演着主角。下面几种物质中含有硅单质的是(? )

参考答案:C
本题解析:玛瑙、水晶、光导纤维的主要成分均是SiO2。
本题难度:简单
4、实验题 (15分)海水蕴含着丰富的资源。在化学实验室里模拟从海水中提取重要的工业原料氯化钠时,设计了以下操作流程:
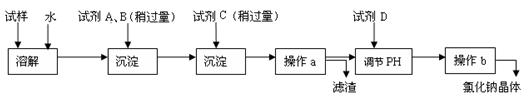
请回答以下问题:
(1)在所提供的试剂中选择:试剂C是?
①Na2CO3?②BaCl2?③稀盐酸
(2)操作b中用到的主要仪器为酒精灯、?、三脚架和玻璃棒。
(3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积。试按下图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是:
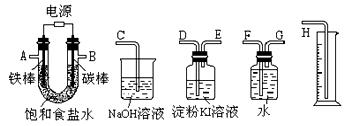
A接?,?接?;B接?,?接?。
(4)写出通入C后,烧杯中所发生的离子反应方程式?
(5)电解氯化钠溶液时的离子方程式为?
若装入的饱和食盐水为75mL,接通电源一段时间,停止通电后,测得氢气为8.4mL(标准状况)。将U形管内的溶液混合均匀,其pH约为_______ 。(假设电解前后溶液体积变化可忽略不计,产生的气体全部逸出)
(6)若想准确读取所得氢气的体积,应采取的操作有?
参考答案:(15分)
(1)(1分)?①?
(2)(1分)?蒸发皿?
(3)(4分)A接? G?,? F?接? H?; B接___D __,___E? _接___ C? _
(4)(2分)?Cl2+ 2OH - ==Cl - +ClO - +H2O
(5)(4分)2Cl - + 2H2O  2OH - + Cl2↑+ H2↑?pH约为12?
2OH - + Cl2↑+ H2↑?pH约为12?
(6)(3分)量筒中液面和广口瓶液面相平;读数时视线与量筒凹液面相平;待整套装置恢复至室温时再行读取数据
本题解析:略
本题难度:简单
5、填空题 向20mL盐酸和硫酸的混合酸溶液中,渐渐加入
0.1mol/L的Ba(OH)2溶液。生成沉淀的质量和溶液的pH变化曲线如右图。根据此实验数据计算:
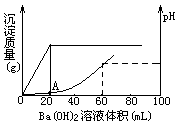 ?
?
(1)原溶液中硫酸和盐酸的浓度各为多少_________________。
(2)A点处溶液的pH是______________。
参考答案:(1)c(H2SO4)="0.1mol/L?" c(HCl)="0.4mol/L?"
(2) pH=0.7
本题解析:本题以图示形式检查酸、碱中和生成沉淀质量和溶液pH曲线随加入Ba(OH)2溶液体积变化情况,此题属于理解层次的中等难度试题。
(1)依据图示,沉淀最大时已加入Ba(OH)2溶液20mL,混合酸中硫酸被完全中和。所以原混合酸中硫酸的物质的量浓度为0.1mol/L。
当H2SO4刚被Ba(OH)2溶液中和时,可以认为溶液中盐酸未被中和。从20mL起,再加Ba(OH)2溶液至60mL时溶液中盐酸全被中和完,溶液呈中性,pH=7,所以原混合酸中盐酸的物质的量浓度为0.4mol/L。
(2)A点处溶液中氢离子浓度是盐酸提供的,因H2SO4刚被Ba(OH)2溶液中和,溶液被冲稀,体积扩大到原来的2倍,则盐酸浓度缩小到原来的1/2,由原来的0.4mol/L变为0.2mol/L。即氢离子浓度为0.2mol/L。所以pH=0.7。
本题难度:简单