微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列金属中在常温下不溶于浓硝酸的是
A.锌
B.镁
C.铝
D.铜
参考答案:C
本题解析:试题分析:常温下,铝在浓硝酸中发生钝化,不会溶解,其余都是反应的,答案选C。
考点:考查金属和浓硝酸反应的有关判断
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的训练和检验,难度不大,该题的关键是记住常见金属和硝酸的反应,然后灵活运用即可。
本题难度:一般
2、选择题 下列叙述正确的是
A.Na+有很强的还原性
B.钠在空气中燃烧生成氧化钠
C.过氧化钠可作供氧剂
D.热稳定性:Na2CO3<NaHCO3
参考答案:C
本题解析:分析:A、根据化合价来判断;
B、钠在空气中燃烧生成过氧化钠;
C、过氧化钠与二氧化碳反应生成氧气;
D、根据热稳定性:Na2CO3>NaHCO3.
解答:A、Na+的化合价由+1价降低为0,具有氧化性,故A错误;
B、钠在空气中燃烧生成过氧化钠,故B错误;
C、过氧化钠与二氧化碳反应生成氧气,可作供氧剂,故C正确;
D、热稳定性:Na2CO3>NaHCO3,故D错误;
故选C.
点评:本题主要考查了物质的性质,难度不大,根据课本知识可完成.
本题难度:简单
3、选择题 香烟烟雾中含有CO、CO2、SO2、H2O等气体.用a.无水硫酸铜、b.澄清石灰水、c.红热氧化铜、d.生石灰、e.酸性品红溶液等可将其一一检出,检出的正确顺序是
A.混合气→a→e→b→a→d→c
B.混合气→c→d→e→e→a
C.混合气→a→e→e→b→d→c
D.混合气→b→e→a→d→c
参考答案:C
本题解析:检验气体时,必须注意前面实验不能干扰后续实验,确定好检验顺序.特别注意:先检验SO2气体的存在(因SO2也能使澄清石灰水变浑浊),再验证SO2是否除净.
本题难度:简单
4、选择题 现有乙二醇(C2H6O2)与醋酸(CH3COOH)组成的混合物,测得其中氢元素的质量分数为9%,则混合物中氧元素的质量分数为
A.52%
B.37%
C.16%
D.无法确定
参考答案:A
本题解析:分析:乙二醇(C2H6O2)与醋酸(CH3COOH)组成的混合物,碳原子与氧原子个数之比为1:1,碳元素与氧元素的质量之比为12:16,根据氢元素的质量分数计算混合物中碳元素与氧元素的质量分数之和,再根据碳元素与氧元素的质量之比计算氧元素的质量分数.
解答:在混合物中,只有C、H、O三种元素,氢元素的质量分数为9%,
则碳和氧元素的总的质量分数为1-9%=91%,
乙二醇(C2H6O2)与醋酸(CH3COOH)组成的混合物,碳原子与氧原子个数之比为1:1,碳元素与氧元素的质量之比为12:16=3:4,所以氧元素的质量分数为91%×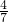 =52%,
=52%,
故选:A.
点评:考查混合物中元素的质量分数的计算,难度中等,关键是利用混合物中各成分的化学式得出C、O的固定组成.
本题难度:困难
5、选择题 将5.4g?Al投入200.0mL?2.0mol?L-1的某溶液中有氢气产生,充分反应后有金属剩余.该溶液可能为
A.HNO3溶液
B.Ba(OH)2溶液
C.H2SO4溶液
D.HCl溶液
参考答案:D
本题解析:分析:200.0mL?2.0mol?L-1的某溶液中溶质的物质的量为0.2L×2.0mol?L-1=0.4mol,Al的物质的量为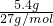 =0.2mol,利用反应判断金属过量,并生成氢气即可.
=0.2mol,利用反应判断金属过量,并生成氢气即可.
解答:200.0mL?2.0mol?L-1的某溶液中溶质的物质的量为0.2L×2.0mol?L-1=0.4mol,Al的物质的量为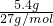 =0.2mol,
=0.2mol,
A、因Al与HNO3溶液不生成氢气,则不符合题意,故A错误;
B、由2Al+2OH-+2H2O═2AlO2-+3H2↑,0.2molAl与0.4molBa(OH)2溶液反应时,碱过量,故B错误;
C、由2Al+6H+═2Al3++3H2↑,0.2molAl与0.4molH2SO4溶液,硫酸过量,故C错误;
D、由2Al+6H+═2Al3++3H2↑,0.2molAl与0.4molHCl溶液,Al过量,故D正确;
故选D.
点评:本题考查铝的化学性质,明确铝与酸碱发生的化学反应是解答的关键,并注意利用量来判断过量问题即可解答.
本题难度:一般