|
高考化学知识点归纳《电解池原理》考点特训(2017年冲刺版)(六)
2017-08-26 03:22:49
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.已知:
CH3OH(l)+O2(g)===CO(g)+2H2O(g) ΔH1=-443.64?kJ/mol
2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0?kJ/mol
(1)试写出CH3OH(l)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:______________________________________________.
(2)科研人员新近开发出一种由强碱作电解质溶液的新型甲醇手机电池,可使手机连续使用一个月才充一次电,据此回答:甲醇在________极反应.
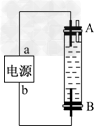
(3)利用电池可实现电能向化学能的转化.某同学设计了一种用电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中不正确的是________(填序号).
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解质溶液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是2H++2e-===H2↑
参考答案:(1)2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1453.28?kJ/mol
(2)负
(3)C
本题解析:
本题难度:一般
2、选择题 某同学设计如下图所示装置,探究氯碱工业原理,下列说法正确的是
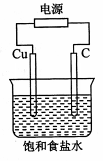
A.石墨电极与直流电源负极相连
B.用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色
C.氢氧化钠在石墨电极附近产生, Na+向石墨电极迁移
D.铜电极的反应式为:2H++ 2e-= H2↑
|
参考答案:D
本题解析:A.若该装置是探究氯碱工业原理,则Cu电极应该与电源的负极连接,石墨电极与直流电源正极相连,错误;B.Cu电极为阴极,在阴极发生反应:2H++2e-=H2↑;在阳极C电极上发生反应:2Cl—-2e-=Cl2↑;所以用湿润KI淀粉试剂在碳电极附近检验气体,试纸变蓝色,错误;C.由于Cu电极为阴极,在阴极发生反应:2H++2e-=H2↑;破坏了附近的水的电离平衡,最终在Cu电极附近氢氧化钠产生, Na+向铜电极迁移,错误;D.铜电极的反应式为:2H++ 2e-= H2↑,正确。
考点:考查电解原理的应用的知识。
本题难度:一般
3、填空题 A、B、C三种强电解质,它们在水中电离出的离子为Na+、Ag+、NO3-、SO42-、Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
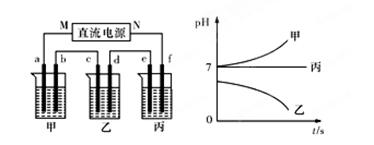
(1)M为电源的 极(填写“正”或“负”),甲、乙两个烧杯中的电解质分别为 ?、 ?(填写化学式)。
(2)计算电极f上生成的气体在标准状况下体积为 ?L。
(3)写出乙烧杯中的电解反应方程式:?。
(4)若电解后甲溶液的体积为10L,则该溶液的pH为 ?。
参考答案:(1)负? NaCl? AgNO3?(2)0.56L (3)4AgNO3+2H2O 4Ag+4HNO3+O2↑ (4)12 4Ag+4HNO3+O2↑ (4)12
本题解析:(1)经过一段时间后,测得乙烧杯中c电极质量增加了10.8克,这说明c电极是阴极,则M是负极,N是正极,f是阳极,e是阴极,d是阴极,b是阴极,a是阴极。乙中电解后pH降低,说明酸性增强,因此电解液应该是硝酸银溶液。甲中pH升高,说明碱性增强,因此电解液应该是氯化钠。丙中pH不变,则相当于是电解水,因此电解液是硫酸钠或硝酸钠。
(2)c电极析出的单质银,物质的量=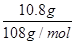 =0.1mol,转移电子的物质的量是0.1mol。f电极是阳极,溶液中的OH-放电,4OH--4e-=2H2O+O2↑。则根据电子转移守恒可知,生成氧气的物质的量是 =0.1mol,转移电子的物质的量是0.1mol。f电极是阳极,溶液中的OH-放电,4OH--4e-=2H2O+O2↑。则根据电子转移守恒可知,生成氧气的物质的量是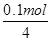 =0.025mol,标准状况下的体积=0.025mol×22.4L/mol=0.56L。 =0.025mol,标准状况下的体积=0.025mol×22.4L/mol=0.56L。
(3)乙中电解质是硝酸银溶液,则电解反应方程式为4AgNO3+2H2O 4Ag+4HNO3+O2↑。 4Ag+4HNO3+O2↑。
(4)甲中电解质是氯化钠,电解的方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,根据电子守恒可知,反应中生成氢氧化钠的物质的量是0.1mol,其浓度是 2NaOH+H2↑+Cl2↑,根据电子守恒可知,反应中生成氢氧化钠的物质的量是0.1mol,其浓度是 =0.01mol/L,则pH=12。 =0.01mol/L,则pH=12。
本题难度:一般
4、简答题 工业上用MnO2和KOH为原料制取高锰酸钾,主要生产过程分两步进行.第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液进行电解,制取KMnO4.试回答以下问题:
(1)制取K2MnO4的MnO2是这一氧化还原反应的______剂(填“氧化”或“还原”),连续搅拌的目的是______.
(2)电解K2MnO4的浓溶液时,两极发生的电极反应式为:
阴极是______,
阳极是______,
电解总的反应方程式是______.
参考答案:(1)根据化合价变化,MnO2化合价有+4价被氧化成K2MnO4的+6价,化合价升高被氧化,作还原剂;将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌,二氧化锰能够与空气充分接触,使MnO2氧化完全,
故答案为:还原剂;与空气充分接触,使MnO2氧化完全;
(2)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-,总方程式为:2MnO42-+2H2O=2MnO4-+H2↑+2OH-,
故答案为:2H2O+2e-=H2↑+2OH-;MnO42--e-=MnO4-;2MnO42-+2H2O=2MnO4-+H2↑+2OH-.
本题解析:
本题难度:一般
5、填空题 塑料电镀是近几十年来发展起来的表面处理新技术,广泛用于电子、家用电器、汽车、建筑等工业。它先是在塑料、陶瓷等非金属表面采用化学沉积的方法沉积出一层金属层,再用电解的方法镀上铜层,电解液为CuSO4水溶液。
(1)请写出电解时,阴极上可能发生的反应:
①______________________________________;②___________________________________。
(2)设通过268 mA的电流60 min后,阴极上沉积出铜0.2879 g,阴极上还可能放出的气体是;该气体在标准状况下的体积是。
参考答案:(1)①Cu2++2e-="===Cu?" ②2H++2e-====H2↑
(2)H2? 1.12×10-2 L
本题解析:(1)得电子能力Cu2+>H+,故阴极上可能发生的反应为:①Cu2++2e-====Cu
②2H++2e-====H2↑
(2)n(e-)=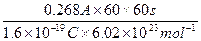 =1.0×10-2 mol =1.0×10-2 mol
由(1)知生成n(Cu)+n(H2)=n(e-)/2=5.0×10-3 mol
n(H2)=5.0×10-3 mol-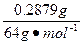 =5.0×10-4 mol, =5.0×10-4 mol,
V(H2)=5.0×10-4mol×22.4 L·mol-1=1.12×10-2 L。
本题难度:简单
|