微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 钒(v)及其化合物广泛应用于工业催化、新材料和新能源等领域。?
V2O5是接触法制硫酸的催化剂。
(1)一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为amol/L和bmol/L,则SO2起始物质的量浓度为____mol/L;生成SO3的化学反应速率为____mol/(L·min)。
(2)工业制硫酸,尾气SO2用___吸收。
全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
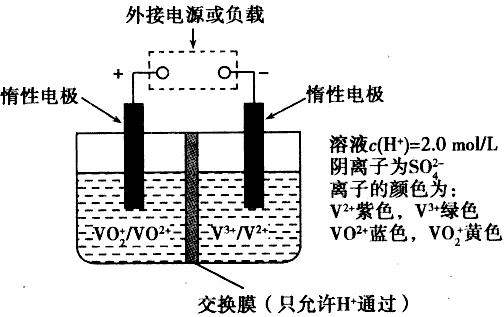
(3)当左槽溶液颜色逐渐由黄变蓝,其电极反应式为____。
(4)充电过程中,右槽溶液颜色逐渐由____色变为____色。
(5)放电过程中氢离子的作用是___和___;充电时若转移的电子数 为3.0l×1023个,左槽溶液中n(H+)的变化量为____。
参考答案:(1)a+b;b/t
(2)氨水
(3)VO2++2H++e- = VO2++H2O
(4)绿;紫
(5)参与正极反应;通过交换膜定向移动使电流通过溶液;0.5 mol
本题解析:
本题难度:一般
2、填空题 (14分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则电解池中X极上的电极反应为?,在X极附近观察到的现象是:?;Y电极上的电极反应式是?。
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是?,电极反应式是?,Y电极的材料是?,电极反应式是?。
参考答案:(1)2H++2e-=H2↑?有气泡,溶液变红;2Cl-—2e-=Cl2↑ (2)纯铜? Cu2++2e-=Cu?粗铜? Cu-2e-=Cu2+
本题解析:(1)X与电源的负极相连,作阴极,溶液中的氢离子放电,反应式2H++2e-=H2↑。由于氢离子放电,破坏了阴极周围水的电离平衡,导致溶液中OH-的浓度大于氢离子的,所以溶液显碱性。Y和电源的正极相连,作阳极,溶液中的氯离子放电,反应式为2Cl-—2e-=Cl2↑。
(2)粗铜精炼时,粗铜和电源的正极相连,作阳极。纯铜和电源的负极相连,作阴极。
本题难度:一般
3、选择题 柯尔贝反应是2RCOOK +?2H2O ?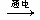 ?R—R +?H2↑+?2CO2+?2KOH(R—代表烃基)。关于无机产物,下列说法正确的是(?)
?R—R +?H2↑+?2CO2+?2KOH(R—代表烃基)。关于无机产物,下列说法正确的是(?)
A.含氢元素的产物均在阳极区上产生
B.含氢元素的产物均在阴极区上产生
C.含碳元素的产物均在阳极区上产生
D.含碳元素的产物均在阴极区上产生
参考答案:BC
本题解析:分析元素的化合价知,H2来自于水,发生了还原反应,同时产生了KOH,应在阴极上产生,R—R虽然含氢元素,但为有机物;含碳的无机物是CO2只能来自于阳极。
本题难度:简单
4、填空题 如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极。电解过程中,发 现石墨电极附近先变红。请回答:
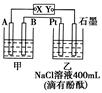
(1)电源X极为?极(填“正”或“负”),乙池中Pt电极上的电极反应式为 ?。
(2)甲池若为电解精炼铜的装置,其阴极增重12.8 g,则乙池中阴极上放出的气体在标准状况下的体积为?,电路中通过的电子为?mol。
(3)在(2)的情况下,若乙池剩余溶液的体积仍为400 mL,则电解后所得溶液c(OH-)=?。
参考答案:(1)正 2Cl--2e-=Cl2↑
(2)4.48 L 0.4
(3)1 mol·L-1
本题解析:(1)由题意得X极为正极,Pt电极为电解池的阳极,电极反应式为2Cl--2e-=Cl2↑。
(2)甲池的阴极电极反应式:Cu2++2e-=Cu。
乙池的阴极电极反应式:2H++2e-=H2↑由电子守恒得:
Cu ~2e- ~H2
64 g?2 mol?22.4 L
12.8 g?n(e-)?V(H2)
则:n(e-)=0.4 mol V(H2)=4.48 L
(3)乙池发生反应:
2Cl-+2H2O 2OH- +H2↑ + Cl2↑
2OH- +H2↑ + Cl2↑
2?22.4 L
n(OH-) ?4.48 L
n(OH-)=0.4 mol
电解后所得溶液c(OH-)=1 mol·L-1
本题难度:一般
5、选择题 下列叙述不正确的是
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2 +2H2O+4e-=4OH—
D.工业上电解饱和食盐水的阴极反应:2Cl一 一2e一=C12↑