微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。

(1)吸硫装置如图所示。

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ??,表明SO2吸收效率低的实验现象是B中溶液 ??。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 ?、??。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
序号
| 实验操作
| 预期现象
| 结论
|
①
| 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。
| _______________
| 样品含NaCl
|
②
| 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。
| _______________
| 样品含NaOH
|
?
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
已知:Cr2O72-+6I-+14H+= 2Cr3++3I2+7H2O? 2S2O32-+I2=S4O62-+2I-
(4)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能?(填“无影响”、“偏低”或“偏高”),原因是?。
参考答案:(1)①品红、溴水或KMnO4溶液;溶液颜色很快褪色或指出相应试剂的正确颜色(红色、黄色等)很快褪色也可得分。?(2分,每个1分)
②增大SO2的接触面积、控制SO2的流速、适当升高温度(答其中二条即可)(4分,每个2分)
(2)(8分,每个2分)
序号
实验操作
预期现象
①
滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡。
有白色沉淀生成
②
加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH
有白色沉淀生成,上层清液pH大于10.2
?
(3)6000a/214V 或3000a/107V? (其它正确答案也给分)?(2分)
(4)偏高;4I—+4H++O2=2I2+2H2O
本题解析:(1)①由于SO2具有还原性、漂白性,因此若 装置B的作用是检验装置A中SO2的吸收效率,则B中试剂可以是品红、溴水或KMnO4溶液,表明SO2吸收效率低的实验现象是B中溶液溶液颜色很快褪色。
②要使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是增大SO2的接触面积、控制SO2的流速、适当升高温度等。
(2)氯离子的检验可以利用硝酸酸化的硝酸银溶液;由于饱和碳酸钙溶液的pH=10.2,所以可以先进入氯化钙溶液,然后测量溶液的pH值进行对比即可,因此答案为:
序号
实验操作
预期现象
①
滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡。
有白色沉淀生成
②
加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH
有白色沉淀生成,上层清液pH大于10.2
?
(3)ag硝酸钾的物质的量是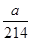 mol,则根据反应式IO3-+5I-+6H+=3I2+3H2O、2S2O32-+I2=S4O62-+2I-可知:IO3-~~~~~6S2O32-
mol,则根据反应式IO3-+5I-+6H+=3I2+3H2O、2S2O32-+I2=S4O62-+2I-可知:IO3-~~~~~6S2O32-
1mol? 6mol
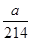 mol?
mol?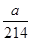 mol×6
mol×6
所以c(Na2S2O3)=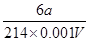 mol/L=
mol/L=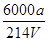 mol/L
mol/L
(4)由于碘离子易被氧化:4I—+4H++O2=2I2+2H2O,因此如果第三步滴速太慢,则导致消耗的硫代硫酸钠溶液的体积增加,从而导致其浓度偏高。
本题难度:困难
2、选择题 下列叙述正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下不容易与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝、锌等金属钝化
参考答案:B
本题解析:浓硫酸使蔗糖炭化,是利用了浓硫酸的脱水性。浓硫酸虽然具有氧化性,但和铜反应时需要加热。氨气是一种碱性气体,不能用浓硫酸来干燥,可以用碱石灰来干燥氨气。在浓硫酸中发生钝化的是铁和铝,不是锌。答案选B。
本题难度:简单
3、选择题 某硫酸厂废气厂SO2的回收利用方案如下图所示,下列说法不正确的是:
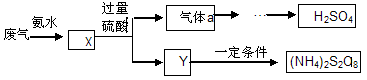
A.X可能含有2种盐
B.a是SO3
C.Y可能含(NH4)2SO4
D.(NH4)2S2O8中S元素的化合价不可能为+7
参考答案:B
本题解析:A.将含有SO2的废气中通入氨水中,若气体少量,发生反应:SO2+2NH3+H2O=(NH4)2SO4,若气体足量,发生反应:SO2+NH3+H2O=NH4HSO4。故X可能含有2种盐。正确。B.向X中加入过量的H2SO4会发生反应产生SO2和NH4HSO4或(NH4)2SO4。SO2氧化得到SO3.SO3被浓硫酸吸收得到硫酸。因此B错误,C正确。由于S原子的最外层电子数为6个,所以在(NH4)2S2O8中S元素的化合价不可能为+7。正确。2的回收利用的工作原理的知识。
本题难度:一般
4、选择题 2008年11月19日新华网:山东恒邦公司排放的污水pH值根本不合格,所含氨氮、硫酸盐超标,这些成分与化工厂所生产的产品成分一致.主厂区位于路西,主要冶炼黄金、生产硫酸和复合肥。下列有关硫酸的说法不正确的是(?)

A.常温下,浓硫酸可以用铝罐贮存,说明浓硫酸强氧化性

B.在蔗糖中加入浓硫酸后出现发黑现象并闻到酸性气味的气体,说明浓硫酸具有脱水性和氧化性

C.M+2H2SO4(浓)=MSO4+SO2↑+2H2O(M表示Zn、Fe、Cu)

D.硫酸工业制法中用98.3%的硫酸吸收SO3,而不用H2O或稀硫酸吸收SO3.
参考答案:C
本题解析:浓硫酸在常温下与铁铝发生钝化,体现浓硫酸的强氧化性,所以常温下铁和浓硫酸的反应很难进行下去,A对C错。在蔗糖中加入浓硫酸后出现发黑现象是浓硫酸将蔗糖脱水炭化,闻到酸性气味的气体是浓硫酸又将炭氧化成了二氧化碳,本身被还原成二氧化硫,说明浓硫酸具有脱水性和氧化性,B正确。硫酸工业制法中用98.3%的硫酸吸收SO3,而不用H2O或稀硫酸吸收SO3.是为了防止形成酸雾,D正确。所以选C。
本题难度:一般
5、选择题 下列关于SO3的描述正确的是(? )
A.常温下是一种无色气体
B.在一定条件下可分解成SO2
C.易溶于水,但不溶于浓H2SO4
D.能与SO2发生氧化还原反应
参考答案:B
本题解析:SO3常温下是一种晶体,溶于水与之反应生成H2SO4,也易溶于浓H2SO4,在一定条件下可分解成SO2。
本题难度:简单