微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质中化学键类型和晶体类型都相同的是( )
A.氯化钠和碳酸钠
B.二氧化碳和二氧化硅
C.碘和白磷
D.铜和氧化铜
参考答案:A、氯化钠和碳酸钠都是离子晶体,氯化钠中只含离子键,碳酸钠中既含离子键又含共价键,故A错误;
B、固体二氧化碳是分子晶体,二氧化硅是原子晶体,二氧化硅、二氧化碳都只含共价键,故B错误;
C、碘和白磷都是分子晶体,都只含共价键,故C正确;
D、铜是金属晶体,氧化铜是离子晶体,铜中含有金属键,氧化铜中含有离子键,故D错误;
故选C.
本题解析:
本题难度:一般
2、填空题 推进器中盛有强还原剂肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)写出过氧化氢的电子式 。
(2)该反应的热化学方程式为 。
1mol肼完全反应转移电子数 。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)又已知H2O(l)==H2O(g);△H = +44kJ?mol-1,由16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
参考答案:(1)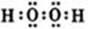 (2)N2H4(l)+2H2O2(l)
(2)N2H4(l)+2H2O2(l)
本题解析:
本题难度:一般
3、选择题 下列叙述错误的是(?)
A.阴、阳离子通过静电吸引所形成的化学键,叫离子键
B.活泼金属元素与活泼非金属元素化合时,形成的是离子键
C.某元素最外层只有一个电子,它与卤素原子结合时所形成的化学键不一定是离子键
D.全部由非金属元素组成的化合物可能是离子化合物
参考答案:A
本题解析:阴、阳离子通过静电作用所形成的化学键,叫离子键,A不正确,B正确,C正确,例如可以是氯化氢,D正确,例如铵盐等,答案选A。
本题难度:一般
4、填空题 (10分) 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
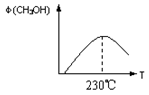
(1)合成甲醇的反应为:CO(g)+2H2(g)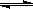 CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H 0。(填“>、<或=”下同)
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H 0。(填“>、<或=”下同)
(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
(3)利用甲醇燃料电池设计如图所示的装置:
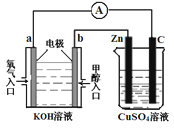
①则该装置中b为 极,写出装置中电解池内发生反应的离子方程式 ,
②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为 L。
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)="=" C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)="=" C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式 。
参考答案:(10分)(1)<(1分)(2)0.55(2分)
(3)①负;(1分) 2Cu2++2H2O 2Cu+O2↑+4H+;(2分)②2.24(2分)
2Cu+O2↑+4H+;(2分)②2.24(2分)
(4)C2H4(g)+H2O(l)="==" C2H5OH(l) △H=-44.2 kJ/mol (2分)
本题解析:略
本题难度:一般
5、填空题 (12分)回答下列问题
(1)CH4、CO2、COCl2和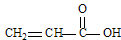 四种分子中,碳原子为sp2杂化的分子是_______________________________________________。
四种分子中,碳原子为sp2杂化的分子是_______________________________________________。
(2)NH3分子的立体构型是___________形,联氨(N2H4)可视为是NH3分子中的一个氢原子被氨基(-NH2)取代所形成的物质,写出联氨加入足量盐酸反应的化学方程式_________________________________________________________________。
(3)H2O、H2O2、OF2和SCl2四种分子中各原子均达8电子结构的分子是________________。
(4)N2H4与H2O2反应:N2H4(l)+2H2O2=N2(g)+4H2O(g) ,若该反应中有4 mol N—H键断裂,则形成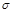 键有_______mol和形成
键有_______mol和形成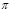 键有_______mol。
键有_______mol。
(5)H2O熔沸点都比H2S高,其原因是___________________________________________。
参考答案:(1) COCl2、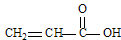 (各1分)
(各1分)
(2) 三角锥(1分)?N2H4+2HCl=N2H6Cl2(3分)
(3) OF2、SCl2(各1分)?(4) 9? 2(各1分)?(5) H2O分子间形成了氢键(2分)
本题解析:(1)甲烷是正四面体型结构,碳原子是sp3杂化。CO2是直线型结构,碳原子是sp杂化。丙烯酸和COCl2中碳原子全部形成1个双键和2个单键,所以是sp2杂化。
(2)氨气中的氮原子含有1对孤对电子,所以是三角锥形。由于联氨(N2H4)可视为是NH3分子中的一个氢原子被氨基(-NH2)取代所形成的物质,所以联氨能形成配位键,方程式为N2H4+2HCl=N2H6Cl2。
(3)只有元素的化合价的绝对值和该原子的最外层电子数之和满足8,才能达到8电子稳定结构,所以只有OF2和SCl2分子中各原子均达8电子结构。
(4)反应中有4 mol N—H键断裂,则必然生成1mol氮气和4mol水,所以可以形成9mol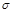 键,和2mol
键,和2mol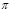 键。
键。
(5)水分子中含有氢键,所以沸点高于H2S的沸点。
本题难度:一般