| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《化学反应与能量》高频考点预测(2017年最新版)(六)
参考答案:C 本题解析:物质液化时需放热,但不是化学反应,A错误;△H=+14.9kJ/mol,该反应为吸热反应,B错误;因反应物的能量高于生成物的能量时,反应是放热反应,C正确;断裂化学键时吸收的能量大于形成化学键共放出的热量,则反应为吸热反应,反之反应为放热反应,D错误,选C. 本题难度:一般 2、选择题 已知热化学方程式: |
参考答案:B
本题解析:②式+①式得 H2O(g)=H2O(1) △H =-44kJ/mol,根据方程式得18g气态水转化为液态水放出44KJ的热量,1g液态水变为水蒸气时吸收热量为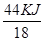 =2.44KJ,答案选B.
=2.44KJ,答案选B.
考点:热化学方程式
本题难度:一般
3、填空题 下表为元素周期表的一部分:
| 族 周期 | | | | |||||
| 1 | ① | | | | | | | |
| 2 | | | | | | ② | | |
| 3 | ③ | | | ④ | | ⑤ | ⑥ | |
参考答案:Ⅰ.(1)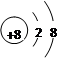 (1分) (2)S2->O2-> Na+(2分) (3)SiCl4
(1分) (2)S2->O2-> Na+(2分) (3)SiCl4
Ⅱ.(4)2Na2O2 +2H2O=4Na+ + 4OH
本题解析:
本题难度:困难
4、填空题 (1)0.3 mol气态高能燃料乙硼烷(分子式B2H6),在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,则其热化学方程式为
(2)又已知:H2O(g) =H2O(l) ; ΔH="-44" kJ/mol,则5.6L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是 。
参考答案:B2H6(g)+3O2=B2O3(s)+3H2O(l) ΔH=-2165 kJ/mol 508.25 kJ
本题解析:(1)根据题意可知,1mol气态高能燃料乙硼烷完全燃烧放出的热量是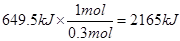 ,所以该反应的热化学方程式为B2H6(g)+3O2=B2O3(s)+3H2O(l) ΔH=-2165 kJ/mol。
,所以该反应的热化学方程式为B2H6(g)+3O2=B2O3(s)+3H2O(l) ΔH=-2165 kJ/mol。
(2)根据盖斯定律可知,乙硼烷完全燃烧生成气态水时热化学方程式是B2H6(g)+3O2=B2O3(s)+3H2O(g) ΔH=-(2165-44×3)kJ/mol=-2033 kJ/mol。5.6L(标准状况)乙硼烷物质的量是0.25mol,所以乙硼烷完全燃烧生成气态水时放出的热量是2033 kJ/mol×0.25mol=508.25 kJ。
考点:考查热化学方程式的书写以及反应热的有关计算
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练。旨在培养学生的规范答题能力。该题的关键是明确反应热的含义、计算依据以及热化学方程式的书写注意事项,然后结合题意灵活运用即可。
本题难度:一般
5、选择题 电解CuCl2溶液时,如果阴极上有1.6 g铜析出,则阳极上产生气体的体积(标准状况)约为
A.0.28 L
B.0.56 L
C.0.14 L
D.11.2 L
参考答案:B
本题解析:试题分析:阴极:Cu2++2e- Cu,则
Cu,则 =0.025 mol,线路中流过0.025 mol×2=0.05 mol电子;阳极:
=0.025 mol,线路中流过0.025 mol×2=0.05 mol电子;阳极:
2Cl--2e- Cl2
Cl2
0.05?
则V(Cl2)=0.025 mol×22.4 L·mol-1=0.56 L,故选B。
考点:考查电极原理的有关计算
点评:该题是高考中的重要考点,属于中等难度的试题。该题的关键是利用好电子的得失守恒,有助于培养学生的逻辑思维能力和创新思维能力,提高学生分析问题、解决问题的能力。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《水的电离平.. | |