微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氯化氢和氧气在一定条件下反应可得到氯气,现将氯化氢和氧气混合于一密闭容器中,在一定条件下使之反应,温度高于100℃,经过5min而达到平衡,经过测定物质的浓度分别为:c(HCl)=0.25mol/L,c(O2)=0.2mol/L,c(Cl2)=0.1mol/L.则:
(1)写出反应的方程式______;
(2)开始时c(HCl)=______,c(O2)=______;
(3)从反应开始到反应平衡时,v(HCl)=______,以HCl、O2、Cl2分别表示的反应速率的数值之比为______;
(4)反应后压强是反应前的______倍.
参考答案:(1)由题意可知,HCl与氧气反应生成氯气,根据元素守恒可知还生成水,反应方程式为:4HCl+O2?2Cl2+2H2O,
故答案为:4HCl+O2?2Cl2+2H2O;
(2)平衡时,c(HCl)=0.25mol/L,c(O2)=0.2mol/L,c(Cl2)=0.1mol/L,根据4HCl+O2?2Cl2+2H2O,可知△c(HCl)=2△c(Cl2)=2×0.1mol/L=0.2mol/L,△c(O2)=12△c(Cl2)=12×0.1mol/L=0.05mol/L,故HCl的起始浓度=0.25mol/L+0.2mol/L=0.45mol/L,O2的起始浓度=0.2mol/L+0.05mol/L=0.25mol/L,
故答案为:0.45mol/L;0.25mol/L;
(3)从反应开始到反应平衡时,v(HCl)=0.2mol/L5min=0.04mol/(L.min);
不同物质表示的速率之比等于其化学计量数之比,故HCl、O2、Cl2分别表示的反应速率的数值之比为4:1:2,
故答案为:0.04mol/(L.min);4:1:2;
(4)根据4HCl+O2?2Cl2+2H2O,可知△c(H2O)=△c(Cl2)=0.1mol/L,反应后混合气体总浓度为0.25mol/L+0.2mol/L+0.1mol/L+0.1mol/L=0.65mol/L,反应前,氯化氢与氧气总浓度为0.45mol/L+0.25mol/L=0.7mol/L,故反应后压强是反应前的0.65mol/L0.7mol/L=1314倍,
故答案为:1314.
本题解析:
本题难度:一般
2、填空题 (14分)已知CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数随温度变化如下表:
CO(g)+H2O(g)的平衡常数随温度变化如下表:
t/℃
| 700
| 800
| 850
| 1 000
| 1 200
|
K
| 2.6
| 1.7
| 1.0
| 0.9
| 0.6
|
请回答下列问题:
(1)上述正向反应是________反应(选填“放热”或“吸热”)。
(2)若达平衡后降温,则平衡向________移动,CO2转化率________,正反应速率________(选填“增大”、“减小”或“不变”)。
(3)在850℃发生上述反应,以表中的物质的量投入恒容反应器中,其中向正反应方向移动的有________(选填A、B、C、D、E)
?
| A
| B
| C
| D
| E
|
n(CO2)
| 3
| 1
| 0
| 1
| 1
|
n(H2)
| 2
| 1
| 0
| 1
| 2
|
n(CO)
| 1
| 2
| 3
| 0.5
| 3
|
n(H2O)
| 5
| 2
| 3
| 2
| 1
|
(4)在850℃时,可逆反应:CO2(g)+H2(g) CO(g)+H2O(g),在该容器内各物质的浓度变化
CO(g)+H2O(g),在该容器内各物质的浓度变化 如下:
如下:
时间/min
| CO2
(mol/L)
| H2
(mol/L)
| CO
(mol/L)
| H2O
(mol/L)
|
0
| 0.200
| 0.300
| 0
| 0
|
2
| 0.138
| 0.238
| 0.062
| 0.062
|
3
| c1
| c2
| c3
| c3
|
4
| c1
| c2
| c3
| c3
|
则3 min~4 min平衡后c3=______________,CO2的转化率为____________。
参考答案:
本题解析:略
本题难度:一般
3、填空题 (8分)在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应
PH4I(S) PH3(g) + HI(g)?①?;
PH3(g) + HI(g)?①?;
4PH3(g)  ?P4(g)+ 6 H2(g)?②?;
?P4(g)+ 6 H2(g)?②?;
2HI(g) H2(g) + I2(g)?③
H2(g) + I2(g)?③
以上三反应建立平衡后,测得HI为b mol,I2(气)为c mol,H2为d mol。求:
⑴平衡后,容器内P4(气)和PH3的物质的量(用代数式表示):n(P4)=?,n(PH3)=?。
⑵ a,b,c三者的关系服从a >?(填含b,c的代数式)。
⑶平衡后,增大压强,容器内n(I2)?, n(PH4I)?(增加、减少、不变)
参考答案:(8分)(1)(d-c)/6? b+8/3c-2/3d? (2) b+2c? (3)?减少?增加
本题解析:由题知I2(气)为c mol,则HI分解生成的H2为c mol,PH3分解生成的H2为d mol- c mol,
生成的P4为(d-c)/6 mol,PH4I分解生成的HI、PH3均为2c mol+b mol,则a >2c mol+b mol,
PH3在第②个反应中消耗2(d-c)/3,则PH3剩下b+8/3c-2/3d。增大压强,①②两个反应均逆向移动,第③个反应加压平衡不移动但由于前2个反应均逆向移动,使其也逆向移动,即n(I2) 减少、n(PH4I)增加。
PH4I(S) PH3(g) +? HI(g) ①?; 4PH3(g)
PH3(g) +? HI(g) ①?; 4PH3(g) P4(g)+ 6 H2(g)②?;
P4(g)+ 6 H2(g)②?;
2c mol+b mol?2c mol+b mol? (d-c)/6?d mol- c mol
2HI(g) H2(g) + I2(g)?③?
H2(g) + I2(g)?③?
c mol? c mol
本题难度:一般
4、选择题 有一化学平衡mA(g)+nB(g) pC(g)+qD(g),如下图所示是A的转化率同压强、温度的关系,分析图象可以得出的正确结论是( )
pC(g)+qD(g),如下图所示是A的转化率同压强、温度的关系,分析图象可以得出的正确结论是( )

A.正反应吸热,m+n>p+q
B.正反应吸热,m+n<p+q
C.正反应放热,m+n>p+q
D.正反应放热,m+n<p+q
参考答案:A
本题解析:解决这类图象题目,采用“定一论二”,即把自变量(温度、压强)之一定为恒量,讨论另外两个变量的关系。
本题难度:一般
5、选择题 在一体积可变的密闭容器中,通入1molN2和3 mol H2,发生反应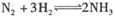 ,在t1时刻达到平衡。保持温度和压强不变,在t2时刻,再通入一部分NH3,反应速率(v)与时间(t)的关系曲线正确的是( )
,在t1时刻达到平衡。保持温度和压强不变,在t2时刻,再通入一部分NH3,反应速率(v)与时间(t)的关系曲线正确的是( )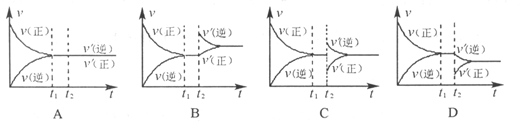
参考答案:C
本题解析:保持温度和压强不变,在t2时刻,再通入一部分NH3,肯定体积增大,此时氨气浓度增大,氮气、氢气浓度减小,即逆反应速率突然加快,正反应速率突然减慢,故选C
本题难度:一般