微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有关常温下pH均为3的醋酸和硫酸的说法正确的是?
[? ]
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
参考答案:A
本题解析:
本题难度:一般
2、填空题 为了证明醋酸是弱电解质,甲、乙、丙、丁、戊、己、庚七人分别选用下列试剂进行实验:
0.10 mol/L醋酸溶液、0.10 mol/L醋酸钠溶液、pH=3的盐酸、pH=3的醋酸、醋酸钠晶体、氯化钠晶体、甲基橙、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10 mol/L的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗??。(填“正确”或“不正确”)
(2)乙取出10 mL 0.10 mol/L的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏水稀释到1 000 mL,再用pH试纸测定其pH=b,要确定醋酸是弱电解质,则a、b应该满足的关系是?(用等式或不等式表示)。
(3)丙取出10 mL 0.10 mol/L醋酸溶液,滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,你认为这一方法能否证明醋酸是弱电解质??。(填“能”或“不能”)
(4)丁用pH试纸来测定0.10 mol/L醋酸钠溶液的pH,发现0.10 mol/L醋酸钠溶液的pH为9,则认定醋酸是弱电解质,你认为这一方法正确吗??。(填“正确”或“不正确”)
参考答案:(1)正确? (2)b<a+2? (3)能? (4)正确
本题解析:(1)正确,若醋酸为强酸,则其溶液的pH=1,现醋酸溶液pH=4,说明醋酸没有完全电离,存在电离平衡。
(2)假设如果它是强酸,稀释100倍,溶液的pH=a+2,因为它是弱酸,故pH<a+2。
(3)能,加入醋酸钠晶体,颜色变橙色,说明溶液的酸性变弱,CH3COO-抑制了醋酸的电离,故醋酸为弱电解质。
(4)正确,由题意知,醋酸钠溶液呈碱性,说明醋酸钠中的醋酸根离子发生了水解,故醋酸为弱酸
本题难度:一般
3、选择题 常温下,体积、物质的量浓度均相等的四种溶液:
①盐酸;②醋酸;③氨水;④CH3COONa溶液。下列说法正确的是
A.将①与②分别稀释相同倍数后溶液的pH:①>②
B.若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3?H2O)
C.③与④中已电离的水分子的数目相等
D.②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
参考答案:B
本题解析:A、体积、物质的量浓度均相等的①与②,因盐酸完全电离,醋酸是弱酸,电离程度较小,pH:①<②,再稀释相同的倍数,仍然是①<②,故A错误;②与③混合后生成醋酸铵溶液,铵根离子和醋酸根离子均发生水解,溶液显中性,说明两者的水解能力相同,故Ka(CH3COOH)=Kb(NH3?H2O),B正确;C、氨水抑制水的电离,醋酸钠溶液中醋酸根离子水解,促进水的电离,故C错误;醋酸和醋酸钠组成的混合溶液显酸性,说明醋酸根离子的水解程度小于醋酸的电离程度,醋酸分子的浓度小于钠离子的浓度,根据电荷守恒可得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),故c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),D错误;故选B。
本题难度:一般
4、填空题 今有①CH3COOH;②HCl;③H2SO4三种溶液,(用序号填空“用>.<.=”)
(1)当它们pH相同时,其物质的量浓度关系是___________。
(2)当它们的物质的量浓度相同时,其pH的关系是___________。
(3)中和等体积.等物质的量浓度的烧碱溶液,需同物质的量浓度的三种酸溶液的体积关系为___________。
(4)当它们pH相同.体积相同时,分别加入足量锌,相同状况下产生气体体积关系为___________。
(5)当它们pH相同.体积相同时,同时加入锌,则开始时反应速率___________,若产生相同体积的气体(相同状况),所需时间___________。
(6)将pH相同的三种酸均稀释10倍后,pH关系为___________。
(7)将pH相同的三种酸加水稀释后,pH仍相同,稀释后三种酸的体积关系___________
参考答案:(1)①>②>③
(2)①>②>③
(3)①=②>③
(4)①>②=③
(5)①=②=③;①<②=③
(6)①<②=③
(7)①>②=③
本题解析:
本题难度:一般
5、简答题 研究化学反应原理对于生产生活是很有意义的.
(1)下列关于醋酸的叙述正确的是______(填写符号).
a.醋酸俗名冰醋酸,是食醋的主要成分
b.向醋酸溶液中加入一定量NaOH固体,溶液的导电性增强
c.加水稀释醋酸溶液,溶液中的所有离子浓度均减小
d.常温下,醋酸溶液中水的电离程度减小
(2)牙釉质对牙齿起着保护作用,其主要成分为Ca5(PO4)3OH,该物质在水中存在沉淀溶解平衡,试写出该物质的溶度积常数表达式Kap=______.
(3)钢铁生锈现象随处可见,钢铁的电化腐蚀原理如图所示:
①写出石墨电极的电极反应式______;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在右图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向.
③写出修改后石墨电极的电极反应式______.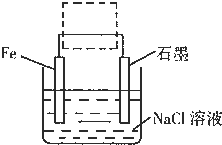
参考答案:(1)a.醋酸俗名冰醋酸,食醋的主要成分就是醋酸,故正确;
b.醋酸是弱电解质,醋酸溶液中离子浓度较小,向醋酸溶液中加入一定量NaOH固体,醋酸和氢氧化钠反应生成强电解质醋酸钠,溶液中离子浓度增大,所以溶液的导电性增强,故正确;
c.加水稀释醋酸溶液,促进醋酸电离,但醋酸分子、氢离子和醋酸根离子浓度都减小,根据水的离子积常数知,溶液中氢氧根离子浓度增大,故错误;
d.常温下,醋酸能电离出氢离子,所以能抑制醋酸溶液中水的电离程度,从而使水的电离程度减小,故正确;
故选abd;
(2)Kap=c(Ca2+)5c(PO43-)3c(OH-),故答案为:Kap=c(Ca2+)5c(PO43-)3c(OH-);
(3)①中性条件下,钢铁发生吸氧腐蚀,铁作负极,石墨作正极,正极上氧气得电子生成氢氧根离子,所以电极反应式为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
②要保护钢铁不受腐蚀,可以把铁设计成电解池的阴极,与电源负极相连接,阴极上氢离子得电子生成氢气,
导线中电子中电子从负极沿导线流向阴极,从阳极沿导线流向正极,故答案为:如图所示
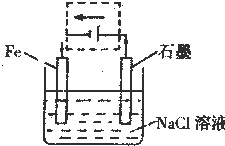
③设计成电解池后,石墨作阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl-2e-=Cl2↑,
故答案为:2Cl-2e-=Cl2↑.
本题解析:
本题难度:一般