|
|
|
高考化学知识点总结《难溶电解质的溶解平衡》高频试题预测(2017年最新版)(九)
2017-09-23 22:30:18
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在100mL 0.01mol/L KCl 溶液中,加入 1mL 0.01mol/L AgNO3溶液,下列说法正确的是(AgCl Ksp=1.8×10-10)
A.有AgCl沉淀析出
B.无AgCl沉淀
C.无法确定
D.有沉淀但不是AgCl
|
2、简答题 过硼酸钠是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中.以硼砂(主要成为Na2B4O7)为原料生产过硼酸钠晶体的主要流程如下:

(1)由Na2B4O7和NaOH反应制NaBO2的离子方程式为______;
(2)沉淀A中含有酸不溶物和氢氧化镁杂质,为了分离出氢氧化镁,在沉淀中加过量的酸,过滤得到含Mg2+的滤液,再在滤液加入碱使Mg2+形成氢氧化镁.若加碱前溶液中c(Mg2+)=0.056mol?L-1,那么需调节溶液的pH=______时,才开始出现沉淀.[已知25℃下Mg(OH)2的Ksp=5.6×10-12]
(3)已知纯品过硼酸钠晶体中各元素的物质的量比为:n(Na):n(B):n(H):n(O)=1:1:n:7.将制得的纯品样品在
70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如右图所示,则T3时所得晶体的化学式为______.(书写简单计算过程)

(4)若反应温度控制不当,所得的过硼酸钠晶体中将混有NaBO2,则产品中钠的质量分数______(填“升高”、“降低”或“不变”).
3、填空题 如图:横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数,回答下列问题:?

(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为____
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=____。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH的范围是____
(4)往1L1.00 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH ____ mol(精确到小数点后2位)。
(5)25℃时,PbCl2固体在盐酸中的溶解度如下: 根据上表数据判断下列说法正确的是____。

A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
4、实验题 Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药等。某生产BaCO3、BaSO4的化工厂生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
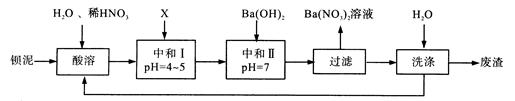
已知: ①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。?
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理:?。
(2)酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为?。
(3)该厂结合本厂实际,选用的X为?(填序号),中和I使溶液中的?(填离子符号)的浓度减小。
A.BaCl2
B.Ba(OH)2
C.Ba(NO3)2
D.BaCO3
|
(4)最后的废渣中除原有的难溶性杂质外还含有
?(填化学式)。
(5)测定所得Ba(NO3)2晶体的纯度:准确称取m1g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m2g,则该晶体纯度的计算表达式为
?。(已知Ba(NO3)2、BaSO4的式量分别为261、233)
5、选择题 实验:
①0.1mol?L-1AgNO3溶液和0.1mol?L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1mol?L-1KI溶液,出现浑浊;
③向沉淀c中滴加0.1mol?L-1KI溶液,沉淀变为黄色.
下列分析不正确的是( )
A.浊液a中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶