微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列元素中,原子半径最大的是?
A.Li
B.Na
C.F
D.Cl
参考答案:B
本题解析:同周期自左向右原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,所以钠的原子半径最大,答案选B。
点评:该题是基础性试题的考查,也是高考中的常见考点,难度不大。该题基础性强,侧重对学生基础知识的巩固和训练,该题的关键是记住原子半径的变化规律,并能灵活运用即可。
本题难度:简单
2、选择题 下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )。
元素代号
| L
| M
| Q
| R
| T
|
原子半径/nm
| 0.160
| 0.143
| 0.089
| 0.102
| 0.074
|
主要化合价
| +2
| +3
| +2
| +6、-2
| -2
|
?
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物既能与酸反应又能与强碱反应
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为Q>L
参考答案:B
本题解析:根据R和T的化合价及原子半径可以推测:R是硫元素,T是氧元素,再根据Q、T、L的半径关系可以推测出Q是铍元素,L是镁元素,再根据L、M的半径关系和化合价推测M是铝元素。M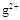 和
和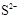 的核外电子数不相等,A错;Al2O3既能与酸反应又能与强碱反应,B正确;氢化物的稳定性H2S<H2O,C错;单质与浓度相同的盐酸反应的速率Be<Mg,所以D错误。
的核外电子数不相等,A错;Al2O3既能与酸反应又能与强碱反应,B正确;氢化物的稳定性H2S<H2O,C错;单质与浓度相同的盐酸反应的速率Be<Mg,所以D错误。
本题难度:一般
3、选择题 要验证Mg、Fe、Cu三种金属的活动性顺序,可选用下列哪组物质进行实验
A.Fe、CuSO4溶液、MgCl2溶液
B.Fe、MgCl2溶液、FeCl2溶液
C.Mg、CuO、FeSO4溶液
D.Cu、FeCl2溶液、MgCl2溶液
参考答案:A
本题解析:验证Mg、Fe、Cu三种金属的活动性顺序,可以用铁来分别置换铜与镁,置换出来,说明比铁的活泼性弱,否则比铁的活泼性强。
点评:属于简单题,
本题难度:一般
4、填空题 (16分) 现有A、B、C、D四种短周期非金属元素,它们的原子最外层电子数之和为19。在它们的化合物中,主要化合价均不止一种,但都有一种相同的化合价,C的单质常用于太阳能电池。它们的一些物理量如下:
元素
| A
| B
| C
| D
|
原子半径/nm
| 0.102
| 0.077
| 0.117
| 0.075
|
单质的沸点/℃
| 444.6
| 4827
| 2355
| –195.8
|
(1)A的元素符号为__________,D元素在周期表第_______周期、第_______族。
(2)在常温下,B与C的最高价氧化物分别为气态和固态,原因是____________________。
(3)含D的两种常见化合物发生化合反应可生成一种离子化合物,该离子化合物撞击时可分解为两种非金属单质和一种化合物,其中一种为D单质,写出该分解反应的化学方程式____________________________________________________________________。
(4)A、B、C、D均能分别形成含18个电子的氢化物,这些氢化物的分子式分别是________________________________________________。
(5)B、D及氢元素中的两种或三种可形成多种含14个电子的化合物,其中空间构型为直线型的是_______________________和_______________________(写结构式)。
参考答案:(1) S,二,ⅤA
(2) CO2是分子晶体,而SiO2为原子晶体
(3) 2NH4NO3  2N2↑+ O2↑+ 4H2O
2N2↑+ O2↑+ 4H2O
(4) H2S、C2H6、SiH4、N2H4
(5) H—C≡C—H? H—C≡N
本题解析:(1)本题的切入点为:C的单质常用于太阳能电池,则C是硅元素,而且从表中数据可以看出,B、C的单质属于原子晶体,所以B为碳元素;D单质的沸点很低,属于分子晶体,状态应为气态,再由“主要化合价均不止一种,但都有一种相同的化合价”和原子半径的大小比较规律,推出D为氮元素。根据它们的原子最外层电子数之和为19,推出A为硫元素。
(2)常温下,B、C的氧化物分别为CO2和SiO2,它们状态不同的原因主要是因为晶体类型不同,CO2是分子晶体,而SiO2为原子晶体,所以CO2是气态,而SiO2为固态。
(3)离子化合物撞击时可分解的物质有所学知识可知为NH4NO3,它的分解方程式为:
2NH4NO3  2N2↑+ O2↑+ 4H2O
2N2↑+ O2↑+ 4H2O
(4)A、B、C、D均能分别形成含18个电子的氢化物,分子式分别是H2S、C2H6、SiH4、N2H4
(5)空间构型为直线型的化合物有二氧化碳、二硫化碳、乙炔、氢氰酸,符合题意的有H—C≡C—H?和? H—C≡N
本题难度:一般
5、选择题 下列各组原子序数所表示的两种元素,能形成AB2型共价化合物的是
A.6和8
B.1和7
C.11和16
D.12和17
参考答案:A
本题解析:略
本题难度:简单