微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 由短周期元素组成的中学常见的无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)。下列推断不正确的是?
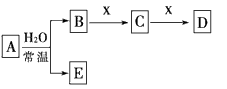
[? ]
A.若X是Na2CO3,C为分子构型为直线型,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH-+HCO3-===H2O+CO32-,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是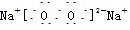
D.若D为白色沉淀,与A摩尔质量相等,则X-定是铝盐
参考答案:A
本题解析:
本题难度:一般
2、填空题 下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其它为化合物,其中C为两性氧化物.试推断:(友情提示:金属Al可在高温下将一些金属从其氧化物中置换出来)

(1)写出物质的化学式:
A:______?B:______?C:______
(2)写出下列反应的方程式:
C→F的离子反应方程式______H→I的化学反应方程式______,相应的实验现象为______.D与过量的稀硝酸反应的离子反应方程式______.
参考答案:C为两性氧化物,应为Al2O3,红棕色粉末B为Fe2O3,则A与B的反应应为铝热反应,A为Al,D为Fe,可与酸反应生成Fe2+,进而与碱反应生成Fe(OH)2,则试剂①为酸,试剂②为碱,则I为Fe(OH)3,E为铝盐,F为偏铝酸盐,
(1)由以上分析可知A为Al,B为Fe2O3,C为Al2O3,故答案为:Al;Fe2O3;Al2O3;
(2)C→F的反应为Al2O3+2OH-=2AlO2-+H2O,H→I的化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,相应的实验现象为白色沉淀迅速变成灰绿色,最终变成红褐色,D与过量的稀硝酸反应的离子反应方程式Fe+4H++NO3-=Fe3++NO↑+2H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;4Fe(OH)2+O2+2H2O=4Fe(OH)3;白色沉淀迅速变成灰绿色,最终变成红褐色;Fe+4H++NO3-=Fe3++NO↑+2H2O.
本题解析:
本题难度:一般
3、填空题 (13分) 如图所示,各物质间有下列转化关系:
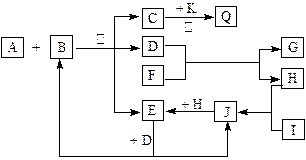
A、F分别为淡黄色固体,A与B的浓溶液反应可以生成C、D、E三种物质,D为无色液体,K为红色金属单质,能在加热条件下与C的浓溶液反应,生成气体Q。I和H为气态双原子分子。反应过程中部分条件和产物均略去。
(1)?I的电子式:____________________。
(2)?反应A + B的化学方程式:_________________________________________________。
(3)?将Q和E按2∶1同时通入品红溶液中,若产物之一含I,则现象可能为___________,原理是(用化学方程式表示)______________________________________________。
(4)?若标准状况下将11.2 L Q通入到500 mL 1.5 mol /L 的G溶液中,请将最终溶液的溶质成分及物质的量填入下表(可不填满)。?
溶质(化学式)
| 物质的量
|
?
| ?
|
?
| ?
|
?
| ?
参考答案:(13分) (1) 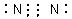 (2分) (2分)
(2) S + 6HNO3(浓) H2SO4 + 6NO2↑+ 3H2O(3分) H2SO4 + 6NO2↑+ 3H2O(3分)
(3) 无明显现象(1分)? 2NO2 + 4SO2 + 4H2O = N2 + 4H2SO4(3分)
(4) (4分,每空1分)
溶质(化学式)
物质的量
Na2SO3
0.25 mol
NaHCO3
0.25 mol
本题解析:略
本题难度:简单
4、填空题 已知A、B为常见的金属单质,C、D为常见的非金属单质,甲、乙、丙为三种常见的化合物,甲是中学化学中常见的红棕色粉末状固体,它们之间的相互转化关系如图所示(部分产物及反应条件没有列出):
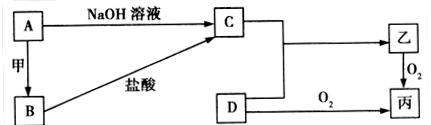
(1)写出框图中A转化为B的化学方程式:_______________________________________,该反应属于______________(填“吸热反应”或“放热反应”)。
(2)若乙的水溶液呈弱酸性,丙是一种大气污染物、有刺激性气味。已知16 g固体单质D完全燃烧转化成丙时,放出148.4 kJ的热量,则该反应的热化学方程式为:
_____________________________________________________________________________。
(3)若乙在水溶液中呈弱碱性,其盐可用作化肥,且C与D化合生成乙的反应是可逆反应。
①将等物质的量的C、D两种单质充入一体积恒定的密闭容器中,在适当催化剂和恒温条件下反应,下列说法中不正确的是____________(填字母)。
a.达到化学平衡时,2υ正(C) = 3υ逆(乙)
b.反应过程中,D单质的体积分数始终为50%
c.达到化学平衡时,混合气体的密度保持不变
d.达到化学平衡的过程中,气体的平均相对分子质量逐渐增大
e.达到化学平衡后,再升高温度,乙的体积分数增大
②若在一个体积为10 L的密闭容器中,充入8 mol C单质和2 mol D单质,在一定温度下发生反应生成气体乙,经40 min后反应达到平衡,此时C的转化率为37.5%。从反应开始到达平衡的40 min内,用物质乙表示的化学反应速率为_________________________;达到平衡后,若向容器中按5∶1∶2的物质的量之比再次充入C、D、乙三种物质,则原平衡体系中C的转化率将_____________(填“增大”、“减小”或“不变”)。
参考答案:(1)2Al + Fe2O3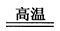 ? Al2O3 + 2Fe(2分)?放热反应(1分) ? Al2O3 + 2Fe(2分)?放热反应(1分)
(2)S(s) + O2(g) = SO2(g);△H ="–296.8" kJ/mol (2分)
(3)①e (2分)? ②0.005 mol/(L?min) (2分)?增大 (1分)
本题解析:略
本题难度:简单
5、选择题 X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体.下列叙述错误的是( )
A.WX4是沼气的主要成分
B.固态X2Y是分子晶体
C.ZW是原子晶体
D.ZY2的水溶液俗称“水玻璃”
参考答案:D
本题解析:
本题难度:一般
|