微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
A.升高温度
B.加入适量的水
C.加入少量CuSO4溶液
D.加入浓度较大的盐酸
参考答案:B
本题解析:根据反应的实质为Zn+2H+═Zn2++H2↑可知,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,以此来解答。
A、升高反应体系温度,反应速率增大,不影响生成氢气的总量,故A错误;
B、加水稀释氢离子的浓度减小,减缓反应速率,但又不影响生成氢气的总量,故B正确;
C、加入少量CuSO4溶液,锌与硫酸铜反应置换出铜,形成原电池,反应速率加快,因为是过量的锌粉,所以不影响生成的氢气总量,故B错误;
D、加浓盐酸,氢离子的浓度增大,加快反应速率,但氢离子的物质的量增多,会影响生成氢气的总量,故D错误,答案选B。
点评:该题是高考中的常见考点,属于中等难度的试题。试题针对性强,贴近高考,侧重对稀释分析、归纳或总结问题的能力的培养,有利于培养学生的逻辑推理能力和灵活应变能力。明确温度、浓度、接触面积对反应速率的影响即可解答,选项C为学生解答中的难点。
本题难度:简单
2、选择题 以下反应均在密闭容器中进行,根据相应的图象,下列相关说法正确的是( )
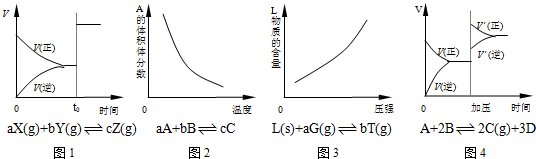
A.图1所示为t0时改变某一条件时速率变化,则改变的条件一定是加入催化剂
B.图2所示为反应达到平衡时温度对化学平衡的影响,则正反应为放热反应
C.图3所示为反应达到平衡时压强对化学平衡的影响,则反应方程式中a<b
D.图4所示为平衡后加压时反应速率的变化,则A、B是气体、D为固体或液体
参考答案:A.图1在t0时正逆反应速率都增大,平衡不移动,不一定是催化剂的原因,如a+b=c,增大压强,反应速率增大,平衡不移动,故A错误;
B.图2A的体积分数随温度的升高而降低,说明温度升高,平衡向正反应方向移动,则正反应为吸热反应,故B错误;
C.图3L物质的含量随压强的增大而增大,说明增大压强平衡向逆反应方向移动,则反应方程式中a<b,故C正确;
D.图4增大压强,平衡向正反应方向移动,说明气体反应物的化学计量数之和大于其它气体生成物的化学计量数之和,则则A、B是气体、D为固体或液体,故D正确.
故选CD.
本题解析:
本题难度:简单
3、简答题 “碘钟”实验中,3I-+S2O
=I+2SO的反应速率可以用I与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃时进行实验,得到的数据如下表:
| 实验编号 | ?① | ?② | ?③ | ?④ | ?⑤
c(I-)/mol?L
0.040
0.080
0.080
0.160
0.160
c(S2O82-)/mol?L
0.040
0.040
0.080
0.020
0.040
t/s
88.0
44.0
22.0
44.0
t2
|
回答下列问题:
(1)该实验的目的是为了探究______因素对化学反应速率的影响.
(2)显色时间t2=______.
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为______(填字母)
A.<22.0s?B.22.0~44.0s?C.>44.0s?D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是______.
参考答案:(1)图表中的物理量是反应物浓度与时间,分析可知,反应物的浓度与时间成反比,浓度的变化量与时间的比值为速率,所以得出反应物浓度与反应速率的关系,
故答案为:应物I-与S2O82-的浓度;
(2)通过分析各组数据知,反应物起始浓度乘积与时间成反比,由①、⑤列比例式,
(0.040 mol?L-1×0.040mol?L-1):(0.160 mol?L-1×0.040mol?L-1)=t1:88.0s,解得t1=22 s
故答案为:22;
(3)温度升高,化学反应速率加快,所用时间越短,故选A;
(4)通过分析知,反应物的浓度乘积与时间成反比,浓度的变化量与时间的比值为速率,
故答案为:反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比).
本题解析:
本题难度:一般
4、选择题 决定一个化学反应速率快慢的最主要因素是( )
A.催化剂
B.温度
C.反应物本身性质
D.浓度
参考答案:影响化学反应速率的主要因素是物质的主要性质,如钠可与冷水发生剧烈反应,而铜与热水在高温下也不反应,说明浓度、温度、压强、催化剂等因素是次要因素.
故选C.
本题解析:
本题难度:一般
5、实验题 (12分)如右图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5 mL 盐酸于试管中.

试回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式:
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”“小于”或“等于”)镁片和盐酸的总能量.
参考答案:(10分)
(1)①镁片上有大量气泡产生;②镁片逐渐溶解;③烧杯中析出晶体
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体
(3)Mg+2H+===Mg2++H2↑
(4)小于
本题解析:略
本题难度:一般