微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:?
组别
| 一元酸
| NaOH
| 混合溶液的pH
|
甲
| c(HX)="0.1" mol/L
| c(NaOH)=0.1mol/L
| pH = a
|
乙
| c(HY)=c1 mol/L
| c(NaOH)=0.1mol/L
| pH = 7
|
丙
| c(HZ)="0.1" mol/L
| c(NaOH)=0.1mol/L
| pH = 9
|
丁
| pH=2? HZ
| pH=12? NaOH
| pH = b
|
(1)甲组实验中HX为弱酸,a?7(填“<”,“=”或“>”),
混合溶液中离子浓度由大到小顺序为?。
(2)乙组实验中HY为强酸,则HY溶液的pH=?。
(3)丙组实验发生反应的离子方程式为?,
所得溶液中由水电离出的c (OH-) = ?mol/L。
(4)丁组实验中b ?7(填“<”,“=”或“>”)。
参考答案:(8分)(1)>(1分) , c(Na+)>c(X-)>c(OH-)>c(H+) (2分) (2)1(1分)
(3)HZ + OH-= H2O + Z-(1分), 10-5 (2分) ?(4)<(1分)
本题解析:(1)甲组实验中HX为弱酸,酸和碱的浓度相等,所以等体积的酸和碱的物质的量相等,恰好反应生成盐和水,生成的盐是强碱弱酸盐其水溶液呈碱性,溶液的PH值大于7,所以溶液中氢氧根离子浓度大于氢离子浓度;由于溶液呈电中性,溶液中阴阳离子所带电荷相等,所以溶液中钠离子浓度大于酸根离子浓度,盐以电离为主水解为次,所以酸根离子浓度大于氢氧根离子浓度,所以c(Na+)>c(X-)>c(OH-)>c(H+)。
(2)乙组实验中HY为强酸,等体积混合后溶液呈中性,说明酸的浓度和碱的浓度相等都是0.1mol/L,酸是强酸,所以酸溶液中氢离子浓度是0.1mol/L,因此酸溶液中pH=1。
(3)等物质的量的酸、碱反应后溶液呈碱性,说明酸是弱酸,酸和碱反应的离子方程式为HZ+OH-=H2O+Z-;常温下,PH=9的溶液中氢离子浓度10-9mol/L,则氢氧根离子浓度是10-5mol/L,这也是水电离出的OH-浓度。
(4)HZ是弱酸,酸的pH=2时,酸的浓度大于0.01mol/L,所以等体积的酸和碱混合后酸过量,导致溶液的pH小于7。
点评:该题是高考中的常见题型,试题基础性强,难易适中,注重考查学生的灵活运用基础知识解决实际问题的能力。本题的关键是明确“谁强谁显性、谁弱谁水解”的规律,同时还充分利用好溶液中的各种守恒关系。
本题难度:一般
2、选择题 某种一元强碱MOH溶液加入一种一元酸HA反应后,溶液呈中性,下列判断一定正确的是
A.加入的酸过量
B.生成的盐不水解
C.酸和碱等物质的量混合
D.反应后溶液中c(A-)=c(M+)
参考答案:D
本题解析:一元强碱MOH溶液加入一种一元酸HA反应后,溶液呈中性,则有c(OH-)=c(H+),如HA为强酸,则物质的量相等,如HA为弱酸,则碱应过量,以此进行分析。A、如HA为强酸,则物质的量相等,故A错误;B、如HA为强酸,,则生成强酸强碱盐,不会水解,故C错误;C、如HA为弱酸,则酸物质的量应过量,混合前酸与碱中溶质的物质的量不等,故B错误;D、溶液呈中性,则有c(OH-)=c(H+),根据溶液电中性原则可知c(A-)=c(M+),故D正确,故选D。
点评:本题考查酸碱混合的计算或判断,题目难度不大,明确碱的强弱是解答本题的关键,并注意电荷守恒的应用来解答。
本题难度:一般
3、选择题 在一瓶PH=1的无色溶液中,已检验出含有Ba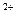 、Ag
、Ag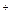 ,则下列粒子:①Cl
,则下列粒子:①Cl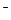 、②Mg
、②Mg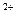 、③Cu
、③Cu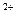 、④ NO
、④ NO 、⑤AlO2—、⑥ CO
、⑤AlO2—、⑥ CO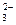 、⑦NH3·H2O在此溶液中不能大量存在的正确组合是
、⑦NH3·H2O在此溶液中不能大量存在的正确组合是
A.①②③⑥⑦
B.②③⑤⑥⑦
C.①③⑤⑥⑦
D.①②⑤⑥⑦